【商品名】爱全乐/Atrovent
【产品名称】异丙托溴铵气雾剂
【汉语拼音】YiBingTuoXiuAnQiWuJi
【英文名】Ipratropium Bromide Aerosol
【成份】主要成分:异丙托溴铵一水合物
【性状】本品在耐压容器中的药液为澄清无色液体,揿压阀门,药液即呈雾粒喷出。
【功能主治】本品适用于预防和治疗与慢性阻塞性气道疾病相关的呼吸困难:慢性阻塞性支气管炎伴或不伴有肺气肿;轻到中度支气管哮喘。
【用法用量】
必须根据个体要求给药。除非医生特别处方,下述剂量一般推荐用于成人和6岁以上儿童:
预防和长期治疗:
每次1-2揿,每日数次;
平均每日剂量1-2揿,每天3-4次。
6岁以下儿童同样适用于上述剂量。
但对于该年龄人群至今尚无充分的用药经验,因此只能在医生监督下使用本品。如果患者需要逐渐增加剂量,则应确认是否需要其他合并治疗,同时每天总的剂量不得超过12揿。
重要说明:
患者应该在医疗监护下治疗。
如果药物治疗不能产生明显的病情改善或导致患者病情恶化,应就诊以更改治疗计划。若发生急性或迅速恶化的呼吸困难,应立即就诊。可能需要额外增加肾上腺皮质激素,β-拟交感类药物或茶碱的治疗。对于急性或迅速恶化的呼吸困难,应立即寻求医疗救护。
这样的病例中,应考虑爱全乐250微克/2毫升吸入用溶液或爱全乐500微克/2毫升吸入用溶液治疗。
用法:
必须正确使用定量气雾器才能达到良好的治疗效果。
爱全乐定量气雾剂只能用于吸入。
患者在吸入时最好坐下或站立。
初次使用定量气雾器前应先将气雾器活瓣揿动两次,弃去。每次使用必须遵循以下的规则:
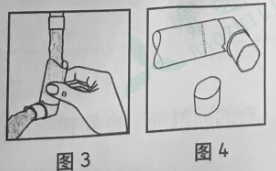
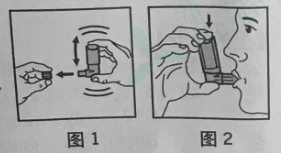
1.除去防尘盖(见图1);
2.深呼气;
3.如图2所示手持定量气雾器,嘴唇合拢咬住喷嘴。容器基底部箭头应指向上方而喷嘴指向下;
4.尽量深呼气,同时用力按动气雾器的基底部,这样就释放一个定量剂量。屏住呼吸数秒钟,然后从口中取出喷嘴,缓慢呼气;
5.用完后重新拧上防尘盖。
需要注意确保吸入剂不喷射到眼内。
儿童需要在成人监督下使用该产品。
其他信息
如果超过3天不使用压力定量气雾器,再次使用前应揿动活瓣一次,弃去。
定量气雾器应该按照如下方法每周清洗一次:
为确保无药物沉积物堵塞喷雾,保持定量吸入器喷嘴清洁非常重要。
清洗气雾器,请先除去防尘盖然后从喷嘴上卸下容器。
用温水冲洗喷嘴直到无可见灰尘。
通过摇动使喷嘴彻底晾干,不能采用任何加热形式晾干。
喷嘴晾干后,安装上容器和防尘盖。
如果没有深呼吸至喷嘴内部,则很容易保持喷嘴清洁。
气雾剂的加压器不应用力打开,或暴露于50℃以上高温。
重要提示:
喷嘴是专门为爱全乐定量气雾剂开发设计,以确保每次释放正确的剂量,因此不能用于其他任何定量吸入剂。同样,除提供的喷嘴,其他喷嘴也不能用于爱全乐定量气雾剂。
摇晃容器查看容器中余留多少液体。定量气雾剂中残余剂量可通过以下方法检查:将加压容器从喷嘴中拉出,并将喷雾剂置于充满水的容器中,喷雾剂的位置就显示了残余剂量的多少。

【药理毒理】
药理作用
异丙托溴铵是一种具有抗胆碱能(副交感)特性的季铵化合物。其通过拮抗迷走神经释放的递质乙酞胆碱而抑制迷走神经的反射.抗胆碱能药物可阻止乙酞胆碱和支气管平滑肌上的毒蕈碱受体相互作用引起的细胞内Ca2+浓度增高。
吸入异丙托溴铵的支气管扩张作用主要是肺部的局部作用而非全身性作用。
【毒理研究】
急性毒理:
雄性豚鼠吸入给药的最小致死剂量为199mg/kg。大鼠给予吸入途径最高剂量时(即0.05mg/kg,吸入4小时,或0.02mg/喷的异丙托溴铵,给予160喷)。未观察到致死现象。
小鼠、大鼠和兔口服的LD50值分别为1585/1925和1920mg/kg。临床症状包括瞳孔散大、口腔黏膜干燥、呼吸困难、震颤、痉挛和/或心动过速。
重复给药毒性
对大鼠、犬和恒河猴进行了6个月的吸入研究,未见不良反应的剂量水平(NOPEL)分别为0.38mg/kg/天,0.18mg/kg/天和0.8mg/kg/天。观察到犬出现口腔黏膜干燥和心动过速。支气管肺系统和任何其他的器官中未见于本品相关的组织病理学损害。大鼠口服给药18个月后NOAEL为0.5mg/kg/天。
遗传毒性试验:Ames试验、体内致突变试验(微核试验、小鼠显性致死试验、中国仓鼠骨髓细胞的细胞质基因试验)均未显示致突变性。
生殖毒性:最高口服剂量,即大鼠1000mg/kg/天,兔125mg/kg/天,在两种动物中均显示母体毒性,并且在大鼠中显示胚胎毒性,同时胎儿体重下降。未观察到与治疗相关的畸形。在吸入可给的最高剂量,大鼠1.5mg/kg/天,图1.8mg/kg/天,未显示对生殖有不良反应。
致癌性:在小鼠和大鼠的长期试验中未发现致瘤性或致癌性。
【药代动力学】
大鼠静脉注射后通过14C一标记的活性成分放射自显影发现,该药不通过胎盘。
本品的治疗作用是通过气道的局部作用产生的.因此支气管扩张的时间曲线与全身药代动力学并不完全一致。吸入后.吸入剂量的10%一30%(依赖于剂型和吸入技术)
吸入后,吸入剂量的10一30%(依赖于剂型和吸入技术)通常沉积在肺内.剂量的大部分被吞咽并经胃肠道排泄。沉积在肺内的部分迅速进入循环系统(数分钟内)。母体化合物累积肾脏排泄(0-24小时)量约为静脉给药的46%,为经口服给药量的小于1%,约为吸入给药量的3一13 %。根据以上数据,异丙托溴铵经口和经吸入给药量的总的全身生物利用度预计分别为2%和7-28%。基于此考虑。异丙托溴铵的吞咽量对全身暴露量无太大影响。异丙托溴铵随HFA134a或CFC抛射剂一起吸入后,24小时累积肾脏排泄量分别约为12%和10%。
异丙托溴铵随HFA134a或CFC抛射剂一起吸入后,24小时累积肾脏排泄量分别约为12%和10%。
异丙托溴铵处置的动力学参数是通过静脉注射后计算血桨浓度获得的。观察到血浆浓度迅速的二相减退。稳态时表观分布容积(Vdss)约为1 76L(约2.4L/kg)。药物与血浆蛋白有少量结合(小于20%)。基于分子的季铵结构.异丙托铵离子不能穿过血脑屏障。终末消除期的半衰期约为1.6小时。
异丙托铵的总清除率为2.3L/min,肾脏的排泄率为0.9L/min。约60%的静脉注射量被代谢,可能主要经肝脏氧化代谢。
在一项分泌平衡研究中.放射性标记的药物相关物质(包括母体药物和所有代谢物)的累积肾脏排泄(6天〕占静脉给药量的72.1%,占口服给药量的9.3%,占吸入给药量的3.2%。经粪便排泄的总的放射性物质占静脉给药量的6.3%,占口服给药量的88.5%,占吸入给药量的69.4%。因此.静脉给药后放射性物质主要经肾排泄。放射性标记的药物相关物质(包括母体药物和所有代谢物)消除半衰期为3.6小时。经尿排泄的主要代谢物与毒蕈性受体结合较弱且被认为是无效物质。
【不良反应】
多数不良反应与本品所具有的抗胆碱能药物特性有关。同其他吸入治疗一样,本品可能出现局部刺激症状。依据临床试验数据和药物批准使用后药物警戒性资料界定药物不良反应。
临床试验报告的最常见不良反应包括头痛、咽喉刺激、咳嗽、口干、胃肠动力障碍(包括便秘、腹泻和呕吐)、恶心和头晕。
不良反应根据系统分类和发生频率罗列如下。
通过采用以下的发生率评估不良反应:
十分常见:≥1/10
常见:≥1/100-<1/10
偶见:≥1/1000-<1/100
罕见:≥1/10000-<1/1000
十分罕见:<1/10000
不明确:依据现有数据无法评估
不良反应有
免疫系统疾病:
偶见:超敏反应、过敏反应
神经系统疾病:
常见:头痛、头晕
眼部疾病:
偶见:视物模糊、瞳孔扩大、眼内压升高、青光眼、眼痛、视觉晕轮、结膜充血、角膜水肿、
罕见:调节障碍
心脏疾病:
偶见:心悸、室上性心动过速
罕见:房颤、心率加快
呼吸、胸腔和纵膈疾病:
常见:咽喉刺激咳嗽
罕见:支气管痉挛、矛盾性支气管痉挛、喉痉挛、咽水肿、咽喉干渴
胃肠道疾病:
常见:口干,恶心、胃肠动力障碍
偶见:腹泻、便秘、呕吐、口腔炎、口腔水肿
皮肤和皮下组织疾病:
偶见:皮疹、瘙痒、血管神经性水肿
罕见:荨麻疹
肾脏和泌尿疾病偶见:尿潴留
【注意事项】
如果在吸入该药物时,呼吸困难突然加重(阵发性支气管痉挛),则应立即停止治疗,就医,并重新评估治疗方案。
超敏反应
使用本品后可能会出现速发型超敏反应极少数病例报告出现皮疹、荨麻疹、血管神经性水肿、口咽部水肿、支气管痉挛及过敏反应等。
矛盾性支气管痉挛
和其他吸入药品一样,本品也可导致矛盾性支气管痉挛,并可能危及生命。如果出现矛盾性支气管痉挛,则应立即停用本品,并换用其他替代治疗。
对于排尿困难的患者如前列腺增生患者,应仔细权衡采用异丙托溴铵治疗的潜在益处和加重尿潴留的风险。
本品含酒精(每个剂量少于100mg)。
眼部并发症
有窄角型青光眼倾向的患者应慎用本品。
当雾化的异丙托溴铵单独与肾上腺素能β2-受体激动剂合用,雾化液进入患者眼睛时,有个别报告出现眼部并发症(如瞳孔散大、眼内压增高、窄角型青光眼、眼痛)。眼痛或眼部不适、视物模糊、与结膜充血所致的红眼有关的视觉晕轮或彩色影像、和角膜水肿可能是急性窄角型青光眼的征象。如果出现上述某些症状,应首先使用缩瞳孔药并立即求助医师。
患者应在指导下正确使用本品。
应注意避免气雾喷射入眼睛。加压吸入溶液是手动控制通过喷嘴给药,因此,气雾喷射入眼睛的风险很小。
肾脏及泌尿系统反应
已经存在尿道阻塞(如前列腺增生或膀胱颈梗阻)的患者应慎用本品。
胃肠动力障碍
有囊性纤维化的患者更易于出现胃肠动力障碍。
对驾驶车辆和操纵机械能力影响的研究。但是,应告知患者在使用本品治疗期间可能会出现不良反应,如头晕、调节障碍、瞳孔散大和视物模糊。因此、在驾驶汽车或操纵机械时应引起注意。
【禁忌】
本品禁用于已知对阿托品或其衍生物(如活性成分异丙托溴铵)或对本品中任何其他成份过敏的患者。
【孕妇及哺乳期妇女用药】 本品在人体妊娠期用药的安全性尚未建立。在已确认妊娠期或可能妊娠期期间使用本品必须权衡用药所带来的益处和胎儿可能造成的危害。临床前研究显示,吸入或鼻内给予明显高于人推荐剂量的本品时,未显示胚胎毒性和致畸性。 目前尚不清楚本品是否通过乳汁排泌。尽管非脂溶性的四价阳离子可进入乳汁,但是当吸入给予本品时,在婴儿体内不太可能达到具有重要意义的量。尽管如此,由于许多药物可通过乳汁排泌,所以哺乳期妇女使用本品应特别慎重。 临床前研究没有发现异丙托溴铵对生育的不良影响(见毒理研究)。尚无异丙托溴铵对生育影响的临床数据。
【儿童用药】参见用法用量。
【老年用药】无特殊注意事项。
【药物相互作用】
使用β-肾上腺素能兴奋剂或黄嘌呤类制剂(如茶碱)可加强本品的作用。
如果同时使用其他抗胆碱能类药物,如含派仑西平制剂的药物,则本品的治疗效果和不良反应均会更加显著。
【药物过量】目前为止尚无过量的特异性症状。基于本品较广的治疗窗和局部给药途径,应不会出现严重的抗胆碱能症状。轻微的全身性抗胆碱能作用包括口干、视力调节障碍和心率增加等可能发生。
【包装规格】不锈钢罐装,10毫升/支
【贮藏】30℃以下保存。气雾剂的加压器不应用开打开,或直接暴露于阳光下或温度超过50℃以上,或冷冻。
【有效期】36个月
【生产企业】Boehringer Ingelheim Pharma GmbH & CO.KG
【分包装企业】上海勃林格殷格翰药业有限公司