гҖҗе•Ҷе“ҒеҗҚгҖ‘
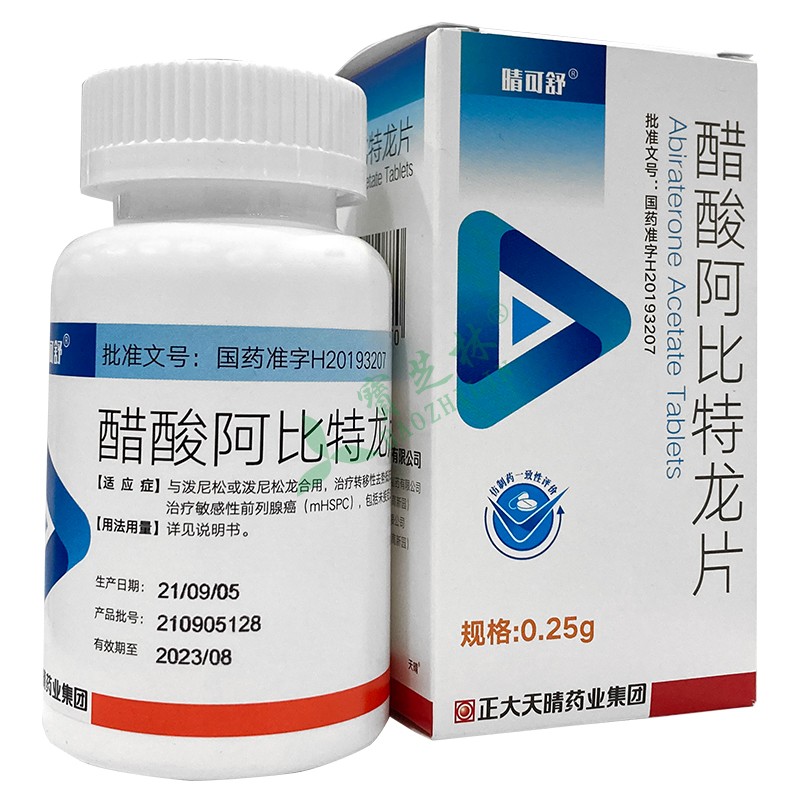
гҖҗдә§е“ҒеҗҚз§°гҖ‘йҶӢй…ёйҳҝжҜ”зү№йҫҷзүҮ
гҖҗиӢұж–ҮеҗҚгҖ‘Abiraterone Acetate Tablets
гҖҗжұүиҜӯжӢјйҹігҖ‘CuSuanABiTeLongPian
гҖҗжҲҗд»ҪгҖ‘
дё»иҰҒжҲҗд»ҪпјҡйҶӢй…ёйҳҝжҜ”зү№йҫҷ
еҢ–еӯҰеҗҚз§°пјҡ17-(3-еҗЎе•¶еҹә)-йӣ„з”ҫ-5,16-дәҢзғҜ-3ОІ-д№ҷй…ёй…Ҝ
еҢ–еӯҰз»“жһ„ејҸпјҡ
еҲҶеӯҗејҸпјҡC26H33NO2
еҲҶеӯҗйҮҸпјҡ391.55
иҫ…ж–ҷпјҡд№ізі–гҖҒеҫ®жҷ¶зәӨз»ҙзҙ гҖҒдәӨиҒ”зҫ§з”ІеҹәзәӨз»ҙзҙ й’ гҖҒиҒҡд№ҷзғҜеҗЎе’Ҝзғ·й…®пјҲK29/32пјүгҖҒеҚҒдәҢзғ·еҹәзЎ«й…ёй’ гҖҒдәҢж°§еҢ–зЎ…гҖҒзЎ¬и„Ӯй…ёй•Ғ
гҖҗжҖ§зҠ¶гҖ‘жң¬е“ҒдёәзҷҪиүІжҲ–зұ»зҷҪиүІзүҮгҖӮ
гҖҗйҖӮеә”з—ҮгҖ‘
жң¬е“ҒдёҺжіје°јжқҫжҲ–жіје°јжқҫйҫҷеҗҲз”ЁпјҢжІ»з–—иҪ¬з§»жҖ§еҺ»еҠҝжҠөжҠ—жҖ§еүҚеҲ—и…әзҷҢпјҲmCRPCпјүпјӣ
ж–°иҜҠж–ӯзҡ„й«ҳеҚұиҪ¬з§»жҖ§еҶ…еҲҶжіҢжІ»з–—ж•Ҹж„ҹжҖ§еүҚеҲ—и…әзҷҢпјҲmHSPCпјүпјҢеҢ…жӢ¬жңӘжҺҘеҸ—иҝҮеҶ…еҲҶжіҢжІ»з–—жҲ–жҺҘеҸ—еҶ…еҲҶжіҢжІ»з–—жңҖй•ҝдёҚи¶…иҝҮ3дёӘжңҲгҖӮ
гҖҗз”Ёжі•з”ЁйҮҸгҖ‘
жҺЁиҚҗеүӮйҮҸ
жң¬е“ҒжҺЁиҚҗеүӮйҮҸдёә1gпјҲ4Г—0.25gзүҮпјүеҸЈжңҚжҜҸж—ҘдёҖж¬ЎгҖӮ
жң¬е“ҒдёҺжіје°јжқҫжҲ–жіје°јжқҫйҫҷ5mgеҸЈжңҚжҜҸж—Ҙ2ж¬ЎиҒ”з”ЁпјҢжІ»з–—иҪ¬з§»жҖ§еҺ»еҠҝжҠөжҠ—жҖ§еүҚеҲ—и…әзҷҢпјҲmCRPCпјүжӮЈиҖ…гҖӮ
жң¬е“ҒдёҺдёҺжіје°јжқҫжҲ–жіје°јжқҫйҫҷ5mgеҸЈжңҚжҜҸж—Ҙ1ж¬ЎиҒ”з”ЁпјҢжІ»з–—ж–°иҜҠж–ӯзҡ„й«ҳеҚұиҪ¬з§»жҖ§еҶ…еҲҶжіҢжІ»з–—ж•Ҹж„ҹжҖ§еүҚеҲ—и…әзҷҢпјҲmHSPCпјүгҖӮ
жҺҘеҸ—жң¬е“ҒжІ»з–—зҡ„жӮЈиҖ…иҝҳеә”еҗҢж—¶жҺҘеҸ—дҝғжҖ§и…әжҝҖзҙ йҮҠж”ҫжҝҖзҙ зұ»дјјзү©пјҲGnRHaпјүжҲ–еә”иҝӣиЎҢиҝҮеҸҢдҫ§зқҫдёёеҲҮйҷӨжңҜгҖӮжң¬е“ҒйЎ»еңЁйӨҗеүҚиҮіе°‘1е°Ҹж—¶е’ҢйӨҗеҗҺиҮіе°‘2е°Ҹж—¶з©әи…№жңҚз”ЁпјҲи§ҒгҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘пјүгҖӮжң¬е“Ғеә”еҪ“дјҙж°ҙж•ҙзүҮеҗһжңҚгҖӮиҜ·еӢҝжҺ°зўҺжҲ–е’ҖеҡјжңҚз”ЁгҖӮ
з”ЁиҚҜжңҹй—ҙжҜ’жҖ§зӣ‘жөӢ
еңЁејҖе§ӢдҪҝз”Ёжң¬е“ҒжІ»з–—д№ӢеүҚпјҢеә”еҪ“жЈҖжөӢиЎҖжё…иҪ¬ж°Ёй…¶пјӣ并еңЁжҺҘеҸ—жІ»з–—зҡ„еүҚ3дёӘжңҲжҜҸдёӨе‘ЁжЈҖжөӢдёҖж¬ЎпјҢжӯӨеҗҺжҜҸдёӘжңҲжЈҖжөӢдёҖж¬ЎгҖӮеҜ№иЎҖеҺӢгҖҒиЎҖжё…й’ҫе’ҢдҪ“ж¶ІжҪҙз•ҷеә”еҪ“жҜҸжңҲзӣ‘жөӢдёҖж¬ЎгҖӮдҪҶеҜ№дәҺеӯҳеңЁе……иЎҖжҖ§еҝғеҠӣиЎ°з«ӯйҮҚеӨ§йЈҺйҷ©зҡ„жӮЈиҖ…пјҢеә”еңЁжҺҘеҸ—жІ»з–—зҡ„еүҚ3дёӘжңҲжҜҸдёӨе‘Ёзӣ‘жөӢдёҖж¬ЎпјҢжӯӨеҗҺжҜҸжңҲзӣ‘жөӢдёҖж¬ЎгҖӮ
еҜ№дәҺжҺҘеҸ—жң¬е“ҒжІ»з–—еүҚжҲ–жІ»з–—жңҹй—ҙеҮәзҺ°дҪҺй’ҫиЎҖз—Үзҡ„жӮЈиҖ…пјҢеә”жіЁж„Ҹз»ҙжҢҒжӮЈиҖ…зҡ„иЎҖй’ҫж°ҙе№ідёҚдҪҺдәҺ4.0mMгҖӮ
еҰӮжһңжӮЈиҖ…еҸ‘з”ҹ3зә§еҸҠ3зә§д»ҘдёҠжҜ’жҖ§дәӢ件пјҢеҢ…жӢ¬й«ҳиЎҖеҺӢгҖҒдҪҺй’ҫиЎҖз—ҮгҖҒж°ҙиӮҝжҲ–е…¶д»–йқһзӣҗзҡ®иҙЁжҝҖзҙ жҜ’жҖ§дәӢ件пјҢеҲҷеә”еҒңжӯўжІ»з–—пјҢ并иҝӣиЎҢйҖӮеҪ“зҡ„еҢ»еӯҰеӨ„зҗҶгҖӮзӣҙеҲ°жҜ’жҖ§з—ҮзҠ¶зј“и§ЈиҮі1зә§жҲ–еҹәзәҝж°ҙе№іпјҢж–№еҸҜйҮҚж–°ејҖе§ӢдҪҝз”Ёжң¬е“ҒжІ»з–—гҖӮ
еҰӮжһңжӮЈиҖ…еҮәзҺ°жјҸжңҚжң¬е“ҒгҖҒжіје°јжқҫжҲ–жіје°јжқҫйҫҷпјҢеә”д»Ҙ常规еүӮйҮҸдәҺж¬Ўж—ҘйҮҚж–°ејҖе§ӢжІ»з–—гҖӮ
иӮқеҠҹиғҪжҚҹе®іе’ҢиӮқжҜ’жҖ§жғ…еҶөдёӢзҡ„еүӮйҮҸи°ғж•ҙеҺҹеҲҷ
иӮқеҠҹиғҪжҚҹе®і
еҹәзәҝиҪ»еәҰиӮқеҠҹиғҪжҚҹе®ізҡ„жӮЈиҖ…дёҚйңҖиҰҒи°ғж•ҙеүӮйҮҸгҖӮ
еҜ№дәҺеҹәзәҝдёӯеәҰиӮқеҠҹиғҪжҚҹе®іпјҲChild-PughBзә§пјүзҡ„жӮЈиҖ…пјҢжң¬е“Ғзҡ„жҺЁиҚҗеүӮйҮҸеә”йҷҚдҪҺиҮі0.25gпјҢжҜҸеӨ©1ж¬ЎгҖӮдёҖйЎ№еңЁеҹәзәҝдёӯеәҰиӮқеҠҹиғҪжҚҹе®іпјҲChild-PughBзә§пјүжӮЈиҖ…дёӯејҖеұ•иҚҜд»ЈеҠЁеҠӣеӯҰз ”з©¶жҳҫзӨәпјҢеңЁеҚ•ж¬ЎеҸЈжңҚз»ҷиҚҜ1gжң¬е“ҒеҗҺпјҢйҳҝжҜ”зү№йҫҷе…Ёиә«жҡҙйңІйҮҸеўһеҠ зәҰ4еҖҚпјҲи§ҒгҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘пјүгҖӮ
еҜ№дәҺдёӯеәҰиӮқеҠҹиғҪжҚҹе®іжӮЈиҖ…пјҢејҖе§ӢжІ»з–—еүҚгҖҒ第1дёӘжңҲжҜҸе‘ЁгҖҒйҡҸеҗҺ2дёӘжңҲжҜҸ2е‘ЁгҖҒд»ҘеҸҠд№ӢеҗҺзҡ„жҜҸдёӘжңҲеә”еҜ№дёҷж°Ёй…ёиҪ¬ж°Ёй…¶пјҲALTпјүгҖҒеӨ©еҶ¬ж°Ёй…ёиҪ¬ж°Ёй…¶пјҲASTпјүе’ҢиғҶзәўзҙ ж°ҙе№іиҝӣиЎҢзӣ‘жөӢгҖӮеҰӮжһңеҹәзәҝдёӯеәҰиӮқеҠҹиғҪжҚҹе®іжӮЈиҖ…зҡ„ALTе’Ң/жҲ–ASTеҚҮй«ҳ>5Г—жӯЈеёёеҖјдёҠйҷҗпјҲULNпјүпјҢжҲ–жҖ»иғҶзәўзҙ еҚҮй«ҳпјһ3Г—ULNпјҢйЎ»еҒңиҚҜдё”еӢҝеҶҚдҪҝз”Ёжң¬е“ҒпјҲи§ҒгҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘пјүгҖӮ
дёҘйҮҚиӮқеҠҹиғҪжҚҹе®іпјҲChild-PughCзә§пјүжӮЈиҖ…дёҚеҫ—дҪҝз”Ёжң¬е“ҒгҖӮеҸҰдёҖйЎ№иҜ•йӘҢеңЁ8дҫӢеҹәзәҝдёҘйҮҚиӮқеҠҹиғҪжҚҹе®іпјҲChild-PughCзә§пјүеҸ—иҜ•иҖ…е’Ң8дҫӢиӮқеҠҹиғҪжӯЈеёёзҡ„еҒҘеә·еҜ№з…§еҸ—иҜ•иҖ…дёӯеҲҶжһҗдәҶйҳҝжҜ”зү№йҫҷзҡ„иҚҜзү©д»Ји°ўеҠЁеҠӣеӯҰгҖӮдёҺиӮқеҠҹиғҪжӯЈеёёзҡ„еҸ—иҜ•иҖ…зӣёжҜ”пјҢеҹәзәҝдёҘйҮҚиӮқеҠҹиғҪжҚҹе®іеҸ—иҜ•иҖ…зҡ„йҳҝжҜ”зү№йҫҷе…Ёиә«жҡҙйңІйҮҸпјҲAUCпјүеўһеҠ 7еҖҚпјҢжёёзҰ»иҚҜзү©йғЁеҲҶзҡ„жҡҙйңІйҮҸеўһеҠ 2еҖҚгҖӮ
иӮқжҜ’жҖ§
еҜ№жң¬е“ҒжІ»з–—жңҹй—ҙеҸ‘з”ҹиӮқжҜ’жҖ§зҡ„жӮЈиҖ…пјҲALTе’Ң/жҲ–AST>5Г—ULNжҲ–жҖ»иғҶзәўзҙ >3Г—ULNпјүпјҢеә”жҡӮж—¶дёӯж–ӯжң¬е“Ғ治疗并и°ғж•ҙеүӮйҮҸпјҲи§ҒгҖҗжіЁж„ҸдәӢйЎ№гҖ‘пјүгҖӮеңЁиӮқеҠҹиғҪж°ҙе№іжҒўеӨҚеҲ°еҹәзәҝж°ҙе№іжҲ–ASTе’ҢALTвүӨ2.5Г—ULNдё”жҖ»иғҶзәўзҙ вүӨ1.5Г—ULNеҗҺпјҢеҸҜйҷҚдҪҺеүӮйҮҸиҮі0.75gжҜҸж—Ҙ1ж¬ЎеҶҚж¬ЎжІ»з–—гҖӮеҜ№жҒўеӨҚжІ»з–—жӮЈиҖ…пјҢиҮіе°‘жҜҸ2е‘Ёзӣ‘жөӢ1ж¬ЎиЎҖжё…иҪ¬ж°Ёй…¶е’ҢиғҶзәўзҙ ж°ҙе№іпјҢ3дёӘжңҲеҗҺжҜҸжңҲзӣ‘жөӢ1ж¬ЎгҖӮ
еҰӮжһң0.75gжҜҸж—Ҙ1ж¬Ўз»ҷиҚҜж—¶еҶҚж¬ЎеҸ‘з”ҹиӮқжҜ’жҖ§пјҢеҸҜеңЁиӮқеҠҹиғҪжЈҖжҹҘеҖјжҒўеӨҚеҲ°еҹәзәҝж°ҙе№іжҲ–ASTе’ҢALTвүӨ2.5Г—ULN并且жҖ»иғҶзәўзҙ вүӨ1.5Г—ULNеҗҺпјҢйҷҚдҪҺеүӮйҮҸиҮі0.5gжҜҸж—Ҙ1ж¬ЎеҶҚж¬ЎжІ»з–—гҖӮ
еҰӮжһң0.5gжҜҸж—Ҙ1ж¬Ўз»ҷиҚҜж—¶еҶҚж¬ЎеҸ‘з”ҹиӮқжҜ’жҖ§пјҢйЎ»еҒңиҚҜгҖӮ
иӢҘж— иғҶз®Ўжў—йҳ»жҲ–е…¶д»–еҜјиҮҙALTе’ҢжҖ»иғҶзәўзҙ еҗҢж—¶еҚҮй«ҳзҡ„еҺҹеӣ пјҢеҪ“жӮЈиҖ…еҮәзҺ°ALTпјһ3Г—ULNдјҙйҡҸжҖ»иғҶзәўзҙ пјһ2Г—ULNж—¶пјҢйңҖж°ёд№…еҒңз”Ёжң¬е“ҒгҖӮ
иӮҫеҠҹиғҪжҚҹе®іжғ…еҶөдёӢзҡ„еүӮйҮҸи°ғж•ҙ
еҜ№иӮҫеҠҹиғҪжҚҹе®іжӮЈиҖ…пјҢж— йңҖиҝӣиЎҢеүӮйҮҸи°ғж•ҙпјҲи§ҒгҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘пјүгҖӮдҪҶеңЁйҮҚеәҰиӮҫжҚҹе®ізҡ„еүҚеҲ—и…әзҷҢжӮЈиҖ…дёӯе°ҡж— дёҙеәҠз»ҸйӘҢпјҢе»әи®®жӯӨзұ»жӮЈиҖ…и°Ёж…ҺдҪҝз”ЁгҖӮ
еҗҲ并дҪҝз”ЁејәCYP3A4иҜұеҜјеүӮж—¶зҡ„еүӮйҮҸи°ғж•ҙ
жң¬е“ҒжІ»з–—жңҹй—ҙйҒҝе…ҚеҗҲ并дҪҝз”ЁејәCYP3A4иҜұеҜјеүӮпјҲеҰӮиӢҜеҰҘиӢұй’ гҖҒеҚЎй©¬иҘҝе№ігҖҒеҲ©зҰҸе№ігҖҒеҲ©зҰҸеёғжұҖгҖҒеҲ©зҰҸе–·дёҒгҖҒиӢҜе·ҙжҜ”еҰҘпјүгҖӮеҰӮжһңеҝ…йЎ»еҗҲ并дҪҝз”ЁејәCYP3A4иҜұеҜјеүӮпјҢйңҖеңЁеҗҲ并用иҚҜжңҹй—ҙеўһеҠ жң¬е“Ғзҡ„з»ҷиҚҜйў‘зҺҮиҮіжҜҸж—Ҙ2ж¬ЎпјҲдҫӢеҰӮпјҢд»Һ1gжҜҸж—Ҙ1ж¬ЎеўһиҮі1gжҜҸж—Ҙ2ж¬ЎпјүгҖӮеңЁеҒңжӯўеҗҲ并дҪҝз”ЁејәCYP3A4иҜұеҜјеүӮеҗҺпјҢеә”е°Ҷжң¬е“Ғи°ғж•ҙиҮіеҺҹз»ҷиҚҜеүӮйҮҸе’Ңйў‘зҺҮпјҲи§ҒгҖҗиҚҜзү©зӣёдә’дҪңз”ЁгҖ‘пјүгҖӮ
иҖҒе№ҙдәә
и§ҒгҖҗиҖҒе№ҙз”ЁиҚҜгҖ‘гҖӮ
е„ҝз«ҘжҲ–йқ’е°‘е№ҙ
е°ҡжңӘзЎ®з«Ӣжң¬е“ҒеңЁе„ҝз«Ҙе’Ңйқ’е°‘е№ҙдёӯзҡ„е®үе…ЁжҖ§е’Ңз–—ж•ҲгҖӮ
гҖҗиҚҜзҗҶжҜ’зҗҶгҖ‘
иҚҜзҗҶдҪңз”Ё
йҶӢй…ёйҳҝжҜ”зү№йҫҷеңЁдҪ“еҶ…иҪ¬еҢ–жҲҗйҳҝжҜ”зү№йҫҷпјҢйҳҝжҜ”зү№йҫҷжҳҜдёҖз§Қйӣ„жҝҖзҙ з”ҹзү©еҗҲжҲҗжҠ‘еҲ¶еүӮпјҢеҸҜжҠ‘еҲ¶17Оұ-зҫҹеҢ–й…¶/C17,20-иЈӮи§Јй…¶пјҲCYP17пјүпјҢеҗҺиҖ…еңЁзқҫдёёгҖҒиӮҫдёҠи…әе’ҢеүҚеҲ—и…әиӮҝзҳӨз»„з»ҮдёӯиЎЁиҫҫ并且жҳҜйӣ„жҝҖзҙ з”ҹзү©еҗҲжҲҗжүҖеҝ…йңҖзҡ„гҖӮ
CYP17еӮ¬еҢ–дёӨдёӘиҝһз»ӯзҡ„еҸҚеә”пјҡ1пјүйҖҡиҝҮ17Оұ-зҫҹеҢ–й…¶еӮ¬еҢ–еӯ•зғҜйҶҮй…®е’Ңеӯ•й…®иҪ¬еҢ–жҲҗеҗ„иҮӘзҡ„17Оұ-зҫҹеҹәиЎҚз”ҹзү©пјӣ2пјүйҡҸеҗҺеңЁC17,20иЈӮи§Јй…¶еӮ¬еҢ–дёӢеҲҶеҲ«еҪўжҲҗи„ұж°ўиЎЁйӣ„й…®е’Ңйӣ„зғҜдәҢй…®гҖӮи„ұж°ўиЎЁйӣ„й…®е’Ңйӣ„зғҜдәҢй…®еқҮдёәйӣ„жҝҖзҙ иҖҢдё”жҳҜзқҫй…®зҡ„еүҚдҪ“гҖӮйҳҝжҜ”зү№йҫҷеҜ№CYP17зҡ„жҠ‘еҲ¶дҪңз”Ёд№ҹеҜјиҮҙиӮҫдёҠи…әзӣҗзҡ®иҙЁжҝҖзҙ з”ҹжҲҗеўһеҠ гҖӮ
йӣ„жҝҖзҙ ж•Ҹж„ҹжҖ§еүҚеҲ—и…әзҷҢеҸҜеҜ№йӣ„жҝҖзҙ ж°ҙе№ійҷҚдҪҺжІ»з–—жі•дә§з”ҹеә”зӯ”гҖӮйӣ„жҝҖзҙ йҳ»ж–ӯз–—жі•еҰӮGnRHaжҲ–зқҫдёёеҲҮйҷӨжңҜеҸҜйҷҚдҪҺзқҫдёёдёӯйӣ„жҝҖзҙ з”ҹжҲҗпјҢдҪҶдёҚиғҪеҪұе“ҚиӮҫдёҠи…әжҲ–иӮҝзҳӨдёӯйӣ„жҝҖзҙ з”ҹжҲҗгҖӮ
еңЁе®үж…°еүӮеҜ№з…§дёҙеәҠиҜ•йӘҢдёӯпјҢйҶӢй…ёйҳҝжҜ”зү№йҫҷеј•иө·жӮЈиҖ…иЎҖжё…зқҫй…®еҸҠе…¶д»–йӣ„жҝҖзҙ ж°ҙе№ійҷҚдҪҺгҖӮдёҙеәҠдҪҝз”ЁдёӯпјҢж— йңҖзӣ‘жөӢжң¬е“ҒеҜ№иЎҖжё…зқҫй…®ж°ҙе№ізҡ„еҪұе“ҚгҖӮ
иЎҖжё…PSAж°ҙе№іеҸҜиғҪеҸҳеҢ–пјҢдҪҶе°ҡжңӘиҜҒе®һе…¶дёҺжӮЈиҖ…дёӘдҪ“зҡ„дёҙеәҠиҺ·зӣҠе…·жңүзӣёе…іжҖ§гҖӮ
жҜ’зҗҶз ”з©¶
йҮҚеӨҚз»ҷиҚҜжҜ’жҖ§пјҡеңЁеӨ§йј 13е‘Ёе’Ң26е‘ЁгҖҒзҢҙ13е‘Ёе’Ң39е‘ЁйҮҚеӨҚз»ҷиҚҜжҜ’жҖ§иҜ•йӘҢдёӯпјҢеңЁзӣёеҪ“дәҺзәҰдәәдёҙеәҠжҡҙйңІйҮҸпјҲAUCпјүдёҖеҚҠзҡ„жғ…еҶөдёӢпјҢйҶӢй…ёйҳҝжҜ”зү№йҫҷеҸҜеј•иө·еҫӘзҺҜзқҫй…®ж°ҙе№ідёӢйҷҚгҖӮеӣ жӯӨпјҢеңЁйӣ„жҖ§е’ҢйӣҢжҖ§з”ҹж®–зі»з»ҹгҖҒиӮҫдёҠи…әгҖҒиӮқи„ҸгҖҒеһӮдҪ“пјҲд»…и§ҒдәҺеӨ§йј пјүе’Ңйӣ„жҖ§д№іи…әдёӯи§ӮеҜҹеҲ°еҷЁе®ҳйҮҚйҮҸдёӢйҷҚе’ҢдёҖе®ҡжҜ’жҖ§гҖӮз”ҹж®–еҷЁе®ҳзҡ„еҸҳеҢ–дёҺйҶӢй…ёйҳҝжҜ”зү№йҫҷзҡ„жҠ—йӣ„жҝҖзҙ иҚҜзҗҶжҙ»жҖ§дёҖиҮҙгҖӮеңЁвүҘ50mg/kg/dayпјҲжҺҘиҝ‘дәҺдәәAUCпјүеүӮйҮҸжҜҸж—ҘеҸЈжңҚз»ҷиҚҜйҶӢй…ёйҳҝжҜ”зү№йҫҷ26е‘ЁеҗҺпјҢи§ӮеҜҹеҲ°еӨ§йј зҷҪеҶ…йҡңеҸ‘з”ҹзҺҮе‘ҲеүӮйҮҸдҫқиө–жҖ§еўһеҠ гҖӮзҢҙ39е‘ЁиҜ•йӘҢдёӯпјҢжҜҸж—ҘеҸЈжңҚйҶӢй…ёйҳҝжҜ”зү№йҫҷпјҢеңЁжӣҙй«ҳзҡ„еүӮйҮҸпјҲй«ҳдәҺдәәAUCзҡ„2еҖҚпјүдёӢжңӘи§ӮеҜҹеҲ°зҷҪеҶ…йҡңгҖӮ
йҒ—дј жҜ’жҖ§пјҡйҶӢй…ёйҳҝжҜ”зү№йҫҷе’ҢйҳҝжҜ”зү№йҫҷAmesиҜ•йӘҢгҖҒдәәж·Ӣе·ҙз»Ҷиғһз»ҶиғһйҒ—дј еӯҰиҜ•йӘҢе’ҢеӨ§йј еҫ®ж ёиҜ•йӘҢз»“жһңеқҮдёәйҳҙжҖ§гҖӮ
з”ҹж®–жҜ’жҖ§пјҡеңЁйӣ„жҖ§еӨ§йј пјҲ13е’Ң26е‘Ёпјүе’ҢзҢҙпјҲ39е‘ЁпјүйҮҚеӨҚз»ҷиҚҜжҜ’жҖ§иҜ•йӘҢдёӯпјҢвүҘ50mg/kg/еӨ©пјҲеӨ§йј пјүе’ҢвүҘ250 mg/kg/еӨ©пјҲзҢҙпјүеүӮйҮҸдёӢеҸҜи§Ғз”ҹж®–зі»з»ҹиҗҺзј©гҖҒж— зІҫ/зІҫж¶ІеҮҸе°‘з—Үд»ҘеҸҠеўһз”ҹжҖ§ж”№еҸҳпјҢе…¶ж•Ҳеә”дёҺйҳҝжҜ”зү№йҫҷзҡ„жҠ—йӣ„жҝҖзҙ иҚҜзҗҶжҙ»жҖ§дёҖиҮҙгҖӮеңЁеӨ§йј е’ҢзҢҙдёӯи§ӮеҜҹеҲ°иҝҷдәӣж•Ҳеә”зҡ„AUCеҲҶеҲ«жҳҜжҺҘиҝ‘е’ҢеӨ§зәҰ0.6еҖҚдәҺдәәзҡ„дёҙеәҠжҡҙйңІйҮҸгҖӮ
еңЁеӨ§йј з”ҹиӮІеҠӣдёҺж—©жңҹиғҡиғҺеҸ‘иӮІжҜ’жҖ§иҜ•йӘҢдёӯпјҢйӣ„жҖ§еӨ§йј з»ҷдәҲ30mg/kg/еӨ©д»ҘеҸҠжӣҙй«ҳеүӮйҮҸ4е‘ЁеҸҜи§Ғз”ҹж®–зі»з»ҹеҷЁе®ҳйҮҚйҮҸйҷҚдҪҺгҖҒзІҫеӯҗи®Ўж•°еҮҸе°‘гҖҒзІҫеӯҗжҙ»еҠӣйҷҚдҪҺгҖҒзІҫеӯҗеҪўжҖҒж”№еҸҳпјҢз”ҹиӮІеҠӣдёӢйҷҚгҖӮжңӘз»ҷиҚҜзҡ„йӣҢжҖ§еӨ§йј дёҺз»ҷдәҲ30mg/kg/еӨ©еүӮйҮҸзҡ„йӣ„жҖ§еӨ§йј дәӨй…ҚпјҢеҜјиҮҙй»„дҪ“ж•°йҮҸеҮҸе°‘гҖҒзқҖеәҠе’Ңеӯҳжҙ»зҡ„иғҡиғҺеҮҸе°‘пјҢзқҖеәҠеүҚдёўеӨұзҺҮеҚҮй«ҳгҖӮйҶӢй…ёйҳҝжҜ”зү№йҫҷеҜ№йӣ„жҖ§еӨ§йј з”ҹиӮІеҠӣзҡ„еҪұе“ҚеҸҜеңЁеҒңиҚҜ16е‘ЁеҗҺжҒўеӨҚгҖӮйӣҢжҖ§еӨ§йј дәҺдәӨй…ҚеүҚдёӨе‘ЁиҮіеҰҠеЁ з¬¬7еӨ©з»ҷдәҲйҶӢй…ёйҳҝжҜ”зү№йҫҷ30mg/kg/еӨ©д»ҘеҸҠжӣҙй«ҳеүӮйҮҸпјҢеҸҜеј•иө·еҠЁжғ…е‘ЁжңҹдёҚ规еҲҷжҲ–延иҝҹзҡ„еҸ‘з”ҹзҺҮд»ҘеҸҠзқҖеәҠеүҚдёўеӨұзҺҮеҚҮй«ҳпјҲ300mg/kg/еӨ©пјүгҖӮз»ҷдәҲйҶӢй…ёйҳҝжҜ”зү№йҫҷзҡ„йӣҢжҖ§еӨ§йј еңЁдәӨй…ҚиғҪеҠӣгҖҒз”ҹиӮІеҠӣеҸҠе…¶еӯҗд»Јеҗ„ж–№йқўзҡ„еҸӮж•°жңӘи§Ғе·®ејӮгҖӮйҶӢй…ёйҳҝжҜ”зү№йҫҷеҜ№йӣҢжҖ§еӨ§йј зҡ„еҪұе“ҚеҸҜеңЁеҒңиҚҜ4е‘ЁеҗҺжҒўеӨҚгҖӮжҢүз…§дҪ“иЎЁйқўз§ҜжҚўз®—пјҢеӨ§йј 30mg/kg/еӨ©зҡ„еүӮйҮҸзәҰдёәдәәжҺЁиҚҗеүӮйҮҸпјҲ1g/еӨ©пјүзҡ„0.3еҖҚгҖӮ
еӨ§йј иғҡиғҺ/иғҺд»”еҸ‘иӮІжҜ’жҖ§иҜ•йӘҢдёӯпјҢеӨ§йј дәҺеҰҠеЁ з¬¬6-17еӨ©з»ҸеҸЈз»ҷдәҲйҶӢй…ёйҳҝжҜ”зү№йҫҷ10гҖҒ30гҖҒ100mg/kgеӨ©пјҲеҲҶеҲ«зәҰзӣёеҪ“дәҺдәәAUCзҡ„0.03еҖҚгҖҒ0.1еҖҚдёҺ0.3еҖҚпјүпјҢеҸҜеј•иө·еҸ‘иӮІжҜ’жҖ§пјҢвүҘ10mg/kg/еүӮйҮҸеҸҜи§ҒиғҡиғҺ/иғҺд»”жӯ»дәЎпјҲзқҖеәҠеҗҺдёўеӨұзҺҮдёҺеҗёж”¶иғҺзҺҮеҚҮй«ҳгҖҒжҙ»иғҺж•°еҮҸе°‘пјүпјҢиғҡиғҺеҸ‘иӮІе»¶иҝҹпјҲйӘЁйӘјпјүдёҺеҸҢдҫ§иҫ“е°ҝз®Ўжү©еј пјҢвүҘ30mg/kg/еүӮйҮҸеҸҜеј•иө·иғҺд»”иӮӣй—Ёз”ҹж®–еҷЁи·қзҰ»зј©зҹӯпјҢ100mg/kg/еүӮйҮҸеҸҜеј•иө·иғҺд»”дҪ“йҮҚеҮҸиҪ»гҖӮвүҘ10mg/kg/еүӮйҮҸеҸҜеј•иө·жҜҚдҪ“жҜ’жҖ§гҖӮ
иҮҙзҷҢжҖ§пјҡеӨ§йј з»ҸеҸЈз»ҷиҚҜдёӨе№ҙиҮҙзҷҢжҖ§иҜ•йӘҢжҳҫзӨәпјҡйӣ„жҖ§еӨ§йј з»ҷдәҲйҶӢй…ёйҳҝжҜ”зү№йҫҷ5гҖҒ15е’Ң50mg/kg/еӨ©пјҢйӣҢжҖ§еӨ§йј 15гҖҒ50е’Ң150mg/kg/еӨ©пјҢеҗ„еүӮйҮҸеқҮеҸҜеј•иө·зқҫдёёй—ҙиҙЁз»Ҷиғһи…әзҳӨе’Ңй—ҙиҙЁз»ҶиғһзҷҢпјҢи®ӨдёәдёҺйҳҝжҜ”зү№йҫҷзҡ„иҚҜзҗҶжҙ»жҖ§жңүе…ігҖӮйҶӢй…ёйҳҝжҜ”зү№йҫҷеңЁдәәжҡҙйңІйҮҸзҡ„0.8еҖҚж—¶пјҢеҜ№йӣҢжҖ§е°Ҹйј жңӘи§ҒиҮҙзҷҢжҖ§гҖӮеңЁTg.rasH2иҪ¬еҹәеӣ е°Ҹйј 6дёӘжңҲиҮҙзҷҢжҖ§иҜ•йӘҢдёӯжңӘи§ҒиҮҙзҷҢжҖ§гҖӮ
гҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘
е·ІеңЁеҒҘеә·еҸ—иҜ•иҖ…е’ҢmCRPCжӮЈиҖ…дёӯиҝӣиЎҢдәҶжң¬е“ҒеҸҠе…¶жҙ»жҖ§д»Ји°ўзү©йҳҝжҜ”зү№йҫҷиҚҜд»ЈеҠЁеҠӣеӯҰз ”з©¶гҖӮеңЁдҪ“еҶ…пјҢжң¬е“Ғиҝ…йҖҹиҪ¬еҢ–жҲҗйҳҝжҜ”зү№йҫҷгҖӮдёҙеәҠз ”з©¶дёӯпјҢпјһ99%еҲҶжһҗж ·жң¬дёӯжң¬е“ҒиЎҖжөҶжө“еәҰдҪҺдәҺжЈҖжөӢж°ҙе№іпјҲпјң0.2ng/mlпјүгҖӮ
еҗёж”¶
mCRPCжӮЈиҖ…еҸЈжңҚжң¬е“ҒеҗҺпјҢйҳҝжҜ”зү№йҫҷдёӯдҪҚиҫҫеі°ж—¶й—ҙдёә2е°Ҹж—¶гҖӮзЁіжҖҒдёӢи§ӮеҜҹеҲ°йҳҝжҜ”зү№йҫҷи“„з§ҜпјҢе…¶жҡҙйңІйҮҸпјҲзЁіжҖҒAUCпјүжҳҜ1gжң¬е“ҒеҚ•ж¬Ўз»ҷиҚҜзҡ„2еҖҚгҖӮ
еңЁmCRPCжӮЈиҖ…дёӯпјҢ1g жҜҸж—Ҙ1ж¬ЎеүӮйҮҸдёӢCmaxе’ҢAUCзЁіжҖҒеҖјпјҲеқҮж•°ВұSDпјүеҲҶеҲ«дёә226Вұ178 ng/mlе’Ң993Вұ639ngh/mlгҖӮеңЁеүӮйҮҸиҢғеӣҙ0.25g-1gеҶ…пјҢжңӘи§ӮеҜҹеҲ°еүӮйҮҸжҜ”дҫӢжҖ§зҡ„йҮҚеӨ§еҒҸзҰ»гҖӮеүӮйҮҸд»Һ1gеўһиҮі2gж—¶пјҢжҡҙйңІйҮҸжІЎжңүжҳҫи‘—еўһеҠ пјҲе№іеқҮAUCеўһеҠ 8%пјүгҖӮ
жң¬е“ҒдёҺйЈҹзү©еҗҢж—¶жңҚз”Ёж—¶пјҢйҳҝжҜ”зү№йҫҷзҡ„е…Ёиә«жҡҙйңІйҮҸеҚҮй«ҳгҖӮжң¬е“ҒдёҺдҪҺи„ӮйӨҗпјҲ7%и„ӮиӮӘпјҢ300еҚЎи·ҜйҮҢпјүеҗҢж—¶жңҚз”Ёж—¶пјҢйҳҝжҜ”зү№йҫҷCmaxе’ҢAUC0-вҲһеҲҶеҲ«еўһеҠ иҮі7еҖҚе’Ң5еҖҚе·ҰеҸіпјӣжң¬е“ҒдёҺй«ҳи„ӮйӨҗпјҲ57%и„ӮиӮӘпјҢ825еҚЎи·ҜйҮҢпјүеҗҢж—¶жңҚз”Ёж—¶пјҢиҝҷдәӣеҖјеҲҶеҲ«еўһеҠ иҮі17еҖҚе’Ң10еҖҚе·ҰеҸігҖӮйүҙдәҺйЈҹзү©зҡ„еӨҡж ·жҖ§е’ҢеҸҜеҸҳжҖ§пјҢжң¬е“ҒдёҺйЈҹзү©еҗҢж—¶жңҚз”ЁеҸҜиғҪдјҡеҜјиҮҙжҡҙйңІйҮҸеҚҮй«ҳдё”жҳ“еҸҳгҖӮж•…иҮіе°‘еңЁжңҚиҚҜеүҚ2е°Ҹж—¶еҶ…е’ҢжңҚиҚҜеҗҺ1е°Ҹж—¶еҶ…дёҚиғҪиҝӣйЈҹгҖӮеҸҰеӨ–пјҢйЎ»з”Ёж°ҙж•ҙзүҮйҖҒжңҚжң¬е“ҒпјҲи§ҒгҖҗз”Ёжі•з”ЁйҮҸгҖ‘пјүгҖӮ
еҲҶеёғе’ҢиӣӢзҷҪз»“еҗҲ
йҳҝжҜ”зү№йҫҷдёҺдәәиЎҖжөҶиӣӢзҷҪгҖҒзҷҪиӣӢзҷҪе’ҢОұ-1й…ёжҖ§зі–иӣӢзҷҪй«ҳеәҰз»“еҗҲпјҲ>99%пјүгҖӮзЁіжҖҒиЎЁи§ӮеҲҶеёғе®№з§ҜпјҲеқҮж•°ВұSDпјүдёә19669Вұ13358 LгҖӮдҪ“еӨ–з ”з©¶жҳҫзӨәеңЁдёҙеәҠзӣёе…іжө“еәҰиҢғеӣҙдёӢпјҢжң¬е“Ғе’ҢйҳҝжҜ”зү№йҫҷеқҮдёҚжҳҜP-зі–иӣӢзҷҪзҡ„еә•зү©пјҢиҖҢжң¬е“ҒжҳҜP-зі–иӣӢзҷҪзҡ„жҠ‘еҲ¶еүӮгҖӮ
д»Ји°ў
еҸЈжңҚ14C-йҶӢй…ёйҳҝжҜ”зү№йҫҷиғ¶еӣҠеҗҺпјҢйҶӢй…ёйҳҝжҜ”зү№йҫҷиў«ж°ҙи§ЈдёәйҳҝжҜ”зү№йҫҷпјҲжҙ»жҖ§д»Ји°ўзү©пјүгҖӮжӯӨиҝҮзЁӢеҸҜиғҪжҳҜеңЁй…Ҝй…¶пјҲе°ҡжңӘйүҙеҲ«й…Ҝй…¶пјүдҪңз”ЁдёӢиҪ¬еҢ–пјҢиҖҢдёҚжҳҜз”ұCYPд»ӢеҜјгҖӮйҳҝжҜ”зү№йҫҷеңЁдәәиЎҖжөҶдёӯзҡ„дёӨдёӘдё»иҰҒеҫӘзҺҜд»Ји°ўзү©дёәзЎ«й…ёйҳҝжҜ”зү№йҫҷпјҲж— жҙ»жҖ§пјүе’ҢN-ж°§еҢ–зЎ«й…ёйҳҝжҜ”зү№йҫҷпјҲж— жҙ»жҖ§пјүпјҢеҗ„еҚ жҡҙйңІйҮҸзҡ„43%е·ҰеҸігҖӮCYP3A4е’ҢSULT2A1еҸӮдёҺN-ж°§еҢ–зЎ«й…ёйҳҝжҜ”зү№йҫҷеҪўжҲҗпјҢдё”SULT2A1д№ҹеҸӮдёҺзЎ«й…ёйҳҝжҜ”зү№йҫҷеҪўжҲҗгҖӮ
жҺ’жі„
еңЁmCRPCжӮЈиҖ…дёӯпјҢйҳҝжҜ”зү№йҫҷеңЁиЎҖжөҶдёӯзҡ„е№іеқҮз»Ҳжң«еҚҠиЎ°жңҹпјҲеқҮж•° Вұ SDпјүдёә12 Вұ5е°Ҹж—¶гҖӮеҸЈжңҚ14C-йҶӢй…ёйҳҝжҜ”зү№йҫҷеҗҺпјҢд»ҺзІӘдҫҝе’Ңе°ҝж¶ІдёӯеҲҶеҲ«еӣһ收зәҰ88%е’Ң5%ж”ҫе°„жҖ§еүӮйҮҸгҖӮзІӘдҫҝдёӯеӯҳеңЁзҡ„дё»иҰҒеҢ–еҗҲзү©дёәжң¬е“ҒеҺҹеһӢе’ҢйҳҝжҜ”зү№йҫҷпјҲеҲҶеҲ«дёәз»ҷиҚҜеүӮйҮҸзҡ„55%е’Ң22%пјүгҖӮ
иӮқеҠҹиғҪжҚҹе®іжӮЈиҖ…
еңЁеҹәзәҝиҪ»еәҰпјҲn=8пјүжҲ–дёӯеәҰпјҲn=8пјүиӮқеҠҹиғҪжҚҹе®іпјҲеҲҶеҲ«дёәChild-Pugh Aе’ҢBзә§пјүеҸ—иҜ•иҖ…е’Ң8дҫӢиӮқеҠҹиғҪжӯЈеёёзҡ„еҒҘеә·еҸ—иҜ•иҖ…дёӯпјҢиҜ„дј°дәҶйҳҝжҜ”зү№йҫҷзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰгҖӮеҹәзәҝиҪ»еәҰе’ҢдёӯеәҰиӮқеҠҹиғҪжҚҹе®іеҸ—иҜ•иҖ…з©әи…№еҚ•ж¬ЎеҸЈжңҚ1gеҗҺпјҢйҳҝжҜ”зү№йҫҷзҡ„е…Ёиә«жҡҙйңІйҮҸеҲҶеҲ«еўһеҠ зәҰ1.1еҖҚе’Ң3.6еҖҚгҖӮеңЁиҪ»еәҰе’ҢдёӯеәҰиӮқеҠҹиғҪжҚҹе®іеҸ—иҜ•иҖ…дёӯпјҢйҳҝжҜ”зү№йҫҷзҡ„е№іеқҮеҚҠиЎ°жңҹеҲҶеҲ«е»¶й•ҝиҮі18е’Ң19е°Ҹж—¶гҖӮ
еҸҰдёҖйЎ№иҜ•йӘҢеңЁ8дҫӢеҹәзәҝжңүдёҘйҮҚиӮқеҠҹиғҪжҚҹе®іпјҲChild-Pugh Cзә§пјүзҡ„еҸ—иҜ•иҖ…е’Ң8дҫӢиӮқеҠҹиғҪжӯЈеёёзҡ„еҒҘеә·еҸ—иҜ•иҖ…дёӯеҲҶжһҗдәҶйҳҝжҜ”зү№йҫҷзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰгҖӮдёҺиӮқеҠҹиғҪжӯЈеёёзҡ„еҸ—иҜ•иҖ…зӣёжҜ”пјҢеҹәзәҝжңүдёҘйҮҚиӮқеҠҹиғҪжҚҹе®іеҸ—иҜ•иҖ…зҡ„йҳҝжҜ”зү№йҫҷе…Ёиә«жҡҙйңІйҮҸпјҲAUCпјүеўһеҠ зәҰ7еҖҚгҖӮжӯӨеӨ–пјҢиҜ•йӘҢеҸ‘зҺ°пјҢеҹәзәҝжңүдёҘйҮҚиӮқеҠҹиғҪжҚҹе®іеҸ—иҜ•иҖ…зҡ„е№іеқҮиӣӢзҷҪз»“еҗҲзҺҮжҜ”иӮқеҠҹиғҪжӯЈеёёеҸ—иҜ•иҖ…дҪҺпјҢеӣ иҖҢдёҘйҮҚиӮқеҠҹиғҪжҚҹе®іеҸ—иҜ•иҖ…зҡ„жёёзҰ»иҚҜзү©йғЁеҲҶзҡ„жҡҙйңІйҮҸеўһеҠ дәҶ2еҖҚпјҲи§ҒгҖҗз”Ёжі•з”ЁйҮҸгҖ‘пјүгҖӮ
иӮҫеҠҹиғҪжҚҹе®іжӮЈиҖ…
еңЁжҺҘеҸ—зЁіе®ҡиЎҖж¶ІйҖҸжһҗж–№жЎҲзҡ„з»Ҳжң«жңҹиӮҫз—…жӮЈиҖ…пјҲn=8пјүе’ҢиӮҫеҠҹиғҪжӯЈеёёзҡ„еҸ—иҜ•иҖ…пјҲn=8пјүдёӯпјҢиҜ„дј°дәҶйҳҝжҜ”зү№йҫҷзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰгҖӮеңЁз»Ҳжң«жңҹиӮҫз—…жӮЈиҖ…з»„дёӯпјҢйҖҸжһҗеҗҺ1е°Ҹж—¶з©әи…№еҚ•ж¬ЎеҸЈжңҚ1gжң¬е“ҒпјҢ并еңЁжңҚиҚҜеҗҺ96е°Ҹж—¶еҶ…йҮҮж ·з”ЁдәҺиҚҜд»ЈеҠЁеҠӣеӯҰеҲҶжһҗгҖӮз»“жһңжҳҫзӨәдёҺиӮҫеҠҹиғҪжӯЈеёёеҸ—иҜ•иҖ…зӣёжҜ”пјҢжҺҘеҸ—йҖҸжһҗзҡ„з»Ҳжң«жңҹиӮҫз—…еҸ—иҜ•иҖ…еҚ•ж¬ЎеҸЈжңҚ1gеҗҺйҳҝжҜ”зү№йҫҷе…Ёиә«жҡҙйңІйҮҸ并жңӘеҚҮй«ҳпјҲи§ҒгҖҗжіЁж„ҸдәӢйЎ№гҖ‘пјүгҖӮ
гҖҗдёҚиүҜеҸҚеә”гҖ‘гҖӮ
е®үе…ЁжҖ§зү№еҫҒжҰӮиҰҒ
з”ұдәҺдҪңз”ЁжңәеҲ¶еҜјиҮҙзҡ„иҚҜж•ҲеҠЁеҠӣеӯҰж•Ҳеә”пјҢжң¬е“ҒеҸҜиғҪдјҡеј•иө·й«ҳиЎҖеҺӢгҖҒдҪҺй’ҫиЎҖз—Үе’ҢдҪ“ж¶ІжҪҙз•ҷгҖӮдёҙеәҠжңҖеёёи§Ғзҡ„дёҚиүҜеҸҚеә”жҳҜеӨ–е‘Ёж°ҙиӮҝгҖҒдҪҺй’ҫиЎҖз—ҮгҖҒй«ҳиЎҖеҺӢе’Ңе°ҝи·Ҝж„ҹжҹ“гҖӮе…¶д»–йҮҚиҰҒзҡ„дёҚиүҜеҸҚеә”еҢ…жӢ¬еҝғи„Ҹз–ҫз—…гҖҒиӮқи„ҸжҜ’жҖ§гҖҒйӘЁжҠҳе’ҢиҝҮж•ҸжҖ§иӮәжіЎзӮҺгҖӮйҖҡеёёпјҢзӣҗзҡ®иҙЁжҝҖзҙ дёҚиүҜеҸҚеә”з»ҸеӨ„зҗҶеҗҺеҸҜд»Ҙеҫ—еҲ°жңүж•Ҳзҡ„жҺ§еҲ¶гҖӮиҒ”еҗҲеә”з”Ёзҡ®иҙЁзұ»еӣәйҶҮиғҪеӨҹйҷҚдҪҺиҝҷдәӣиҚҜзү©дёҚиүҜеҸҚеә”зҡ„еҸ‘з”ҹзҺҮе’ҢдёҘйҮҚзЁӢеәҰгҖӮ
дёҙеәҠиҜ•йӘҢ
з”ұдәҺдёҙеәҠиҜ•йӘҢзҡ„жқЎд»¶еҗ„ејӮпјҢдёҚеҗҢиҚҜзү©зҡ„дёҙеәҠиҜ•йӘҢдёӯи§ӮеҜҹеҲ°зҡ„дёҚиүҜеҸҚеә”еҸ‘з”ҹзҺҮжІЎжңүзӣҙжҺҘеҸҜжҜ”жҖ§пјҢд№ҹж— жі•еҸҚжҳ дёҙеәҠе®һи·өдёӯи§ӮеҜҹеҲ°зҡ„дёҚиүҜеҸҚеә”еҸ‘з”ҹзҺҮгҖӮ
еңЁдёӨйЎ№йҡҸжңәгҖҒе®үж…°еүӮеҜ№з…§гҖҒеӨҡдёӯеҝғдёҙеәҠиҜ•йӘҢпјҲз ”з©¶COU-AA-301е’Ңз ”з©¶COU-AA-302пјүдёӯпјҢжӢӣеӢҹдәҶmCRPCжӮЈиҖ…пјҢе…¶дёӯжІ»з–—з»„жӮЈиҖ…жҜҸеӨ©жңҚз”Ёжң¬е“Ғ1000mgпјҢжҜҸж—Ҙ1ж¬ЎпјҢиҒ”еҗҲжіје°јжқҫ5mgпјҢжҜҸж—Ҙ2ж¬ЎгҖӮеҜ№з…§з»„жңҚз”Ёе®үж…°еүӮпјҢиҒ”еҗҲжіје°јжқҫ5mgпјҢжҜҸж—Ҙ2ж¬ЎгҖӮ第дёүйЎ№йҡҸжңәгҖҒе®үж…°еүӮеҜ№з…§гҖҒеӨҡдёӯеҝғдёҙеәҠиҜ•йӘҢпјҲз ”з©¶212082PCR 3011пјүе…Ҙз»„дәҶй«ҳеҚұmHSPCжӮЈиҖ…гҖӮжІ»з–—з»„жӮЈиҖ…жҜҸеӨ©жңҚз”Ёжң¬е“Ғ1000mgпјҢиҒ”еҗҲжіје°јжқҫпјҲ5 mgпјҢжҜҸж—Ҙ1ж¬ЎпјүжІ»з–—гҖӮеҜ№з…§з»„дёӯзҡ„жӮЈиҖ…жҺҘеҸ—е®үж…°еүӮжІ»з–—гҖӮжӯӨеӨ–пјҢеңЁmCRPCжӮЈиҖ…дёӯејҖеұ•дәҶ2йЎ№йҡҸжңәгҖҒе®үж…°еүӮеҜ№з…§иҜ•йӘҢпјҲз ”з©¶ABI-PRO-3001е’Ңз ”з©¶ABI-PRO-3002пјүгҖӮ5йЎ№йҡҸжңәеҜ№з…§иҜ•йӘҢдёӯ2230дҫӢжӮЈиҖ…зҡ„еҗҲ并е®үе…ЁжҖ§ж•°жҚ®жһ„жҲҗдәҶжіЁж„ҸдәӢйЎ№гҖҒ1~4зә§дёҚиүҜеҸҚеә”д»ҘеҸҠ1~4зә§е®һйӘҢе®ӨжЈҖжҹҘејӮеёёдёӯж•°жҚ®зҡ„дҫқжҚ®гҖӮеңЁжүҖжңүиҜ•йӘҢдёӯпјҢдёӨз»„еқҮйңҖиҰҒжҺҘеҸ—GnRHaжҲ–ж—ўеҫҖжҺҘеҸ—иҝҮзқҫдёёеҲҮйҷӨжңҜгҖӮ
еңЁжұҮжҖ»ж•°жҚ®дёӯпјҢйҳҝжҜ”зү№йҫҷжІ»з–—жӮЈиҖ…зҡ„дёӯдҪҚжІ»з–—жҢҒз»ӯж—¶й—ҙдёә11дёӘжңҲпјҲ0.1пјҢ43пјүпјҢе®үж…°еүӮжІ»з–—жӮЈиҖ…зҡ„дёӯдҪҚжІ»з–—жҢҒз»ӯж—¶й—ҙдёә7.2дёӘжңҲпјҲ0.1пјҢ43пјүгҖӮдёҙеәҠиҜ•йӘҢжҠҘе‘Ҡзҡ„жңҖеёёи§ҒпјҲвүҘ10%пјүзҡ„дё”еңЁйҳҝжҜ”зү№йҫҷжІ»з–—з»„жӣҙеёёи§ҒпјҲвүҘ2%пјүзҡ„иҚҜзү©дёҚиүҜеҸҚеә”дёәз–Ід№ҸгҖҒе…іиҠӮз—ӣгҖҒй«ҳиЎҖеҺӢгҖҒжҒ¶еҝғгҖҒж°ҙиӮҝгҖҒдҪҺй’ҫиЎҖз—ҮгҖҒжҪ®зғӯгҖҒи…№жі»гҖҒе‘•еҗҗгҖҒдёҠе‘јеҗёйҒ“ж„ҹжҹ“гҖҒе’іе—Ҫе’ҢеӨҙз—ӣгҖӮ
дёҙеәҠиҜ•йӘҢжҠҘе‘Ҡзҡ„жңҖеёёи§ҒпјҲпјһ20%пјүзҡ„дё”еңЁйҳҝжҜ”зү№йҫҷжІ»з–—жӣҙеёёи§ҒпјҲвүҘ2%пјүзҡ„е®һйӘҢе®ӨжЈҖжҹҘејӮеёёжҳҜиҙ«иЎҖгҖҒзўұжҖ§зЈ·й…ёй…¶еҚҮй«ҳгҖҒй«ҳз”ҳжІ№дёүй…ҜиЎҖз—ҮгҖҒж·Ӣе·ҙз»ҶиғһеҮҸе°‘з—ҮгҖҒй«ҳиғҶеӣәйҶҮиЎҖз—ҮгҖҒй«ҳиЎҖзі–з—Үе’ҢдҪҺй’ҫиЎҖз—ҮгҖӮ
йҳҝжҜ”зү№йҫҷз»„дёӯ53%зҡ„жӮЈиҖ…д»ҘеҸҠе®үж…°еүӮз»„дёӯ46%зҡ„жӮЈиҖ…жҠҘе‘ҠеҮәзҺ°3-4зә§дёҚиүҜдәӢ件гҖӮйҳҝжҜ”зү№йҫҷз»„дёӯ14%зҡ„жӮЈиҖ…д»ҘеҸҠе®үж…°еүӮз»„дёӯ13%зҡ„жӮЈиҖ…жҠҘе‘ҠеҒңиҚҜгҖӮеҜјиҮҙжң¬е“Ғе’Ңжіје°јжқҫеҒңиҚҜзҡ„еёёи§ҒдёҚиүҜдәӢ件пјҲвүҘ1пј…пјүжҳҜиӮқи„ҸжҜ’жҖ§е’Ңеҝғи„Ҹз—…гҖӮ
йҳҝжҜ”зү№йҫҷз»„дёӯ7.5пј…зҡ„жӮЈиҖ…е’Ңе®үж…°еүӮз»„дёӯ6.6пј…зҡ„жӮЈиҖ…жҠҘе‘ҠеҮәзҺ°дәҶдёҺжІ»з–—дёӯдёҚиүҜдәӢ件зӣёе…ізҡ„жӯ»дәЎгҖӮеңЁйҳҝжҜ”зү№йҫҷз»„дёӯпјҢжңҖеёёи§Ғзҡ„жӯ»дәЎеҺҹеӣ жҳҜз–ҫз—…иҝӣеұ•пјҲ3.3пј…пјүгҖӮе…¶д»–>5дҫӢжӮЈиҖ…жҠҘе‘Ҡзҡ„жӯ»дәЎеҺҹеӣ еҢ…жӢ¬иӮәзӮҺгҖҒеҝғи·іе‘јеҗёйӘӨеҒңгҖҒжӯ»дәЎпјҲж— е…¶д»–дҝЎжҒҜпјүе’ҢдёҖиҲ¬иә«дҪ“зҠ¶еҶөжҒ¶еҢ–гҖӮ
з ”з©¶COU-AA-301пјҡж—ўеҫҖжҺҘеҸ—иҝҮеӨҡиҘҝд»–иөӣеҢ–з–—зҡ„иҪ¬з§»жҖ§еҺ»еҠҝжҠөжҠ—жҖ§еүҚеҲ—и…әзҷҢ
з ”з©¶COU-AA-301жӢӣеӢҹдәҶ1195дҫӢж—ўеҫҖжҺҘеҸ—иҝҮеӨҡиҘҝд»–иөӣеҢ–з–—зҡ„иҪ¬з§»жҖ§еҺ»еҠҝжҠөжҠ—жҖ§еүҚеҲ—и…әзҷҢжӮЈиҖ…гҖӮз ”з©¶и§„е®ҡпјҢжІЎжңүиӮқиҪ¬з§»зҡ„жғ…еҶөдёӢпјҢиӢҘASTе’Ң/жҲ–ALTвүҘ2.5Г—ULNпјҢеҲҷиҜҘжӮЈиҖ…дёҚиғҪе…Ҙз»„гҖӮжңүиӮқиҪ¬з§»зҡ„жӮЈиҖ…пјҢиӢҘASTе’Ң/жҲ–ALT>5Г—ULNд№ҹдёҚз¬ҰеҗҲе…Ҙз»„жқЎд»¶гҖӮиЎЁ1жҳҫзӨәз ”з©¶COU-AA-301дёӯжң¬е“ҒжІ»з–—з»„дёҚиүҜеҸҚеә”еҸ‘з”ҹзҺҮиҫғе®үж…°еүӮз»„еўһеҠ вүҘ2%зҡ„дёҚиүҜеҸҚеә”жҲ–йңҖзү№еҲ«е…іжіЁзҡ„дёҚиүҜдәӢ件гҖӮжң¬е“ҒиҒ”еҗҲжіје°јжқҫзҡ„дёӯдҪҚжІ»з–—ж—¶й—ҙжҳҜ8дёӘжңҲгҖӮ
иЎЁ1 з ”з©¶301дёӯйҶӢй…ёйҳҝжҜ”зү№йҫҷз»„еҸ‘з”ҹзҺҮиҫғе®үж…°еүӮз»„й«ҳвүҘ2%зҡ„дёҚиүҜеҸҚеә”жҲ–йңҖзү№еҲ«е…іжіЁзҡ„дёҚиүҜдәӢ件

иЎЁ2жҳҫзӨәдәҶз ”з©¶COU-AA-301дёӯе…іжіЁзҡ„е®һйӘҢе®ӨжЈҖжҹҘејӮеёёгҖӮ

з ”з©¶COU-AA-302пјҡжңӘз»ҸеҢ–з–—зҡ„иҪ¬з§»жҖ§еҺ»еҠҝжҠөжҠ—жҖ§еүҚеҲ—и…әзҷҢ
з ”з©¶COU-AA-302жӢӣеӢҹдәҶ1088дҫӢж—ўеҫҖжңӘз»ҸеҢ–з–—зҡ„иҪ¬з§»жҖ§еҺ»еҠҝжҠөжҠ—жҖ§еүҚеҲ—и…әзҷҢжӮЈиҖ…гҖӮз ”з©¶жҺ’йҷӨдәҶдјҙжңүиӮқиҪ¬з§»зҡ„жӮЈиҖ…пјҢASTе’Ң/жҲ–ALTвүҘ2.5Г—ULNзҡ„жӮЈиҖ…д№ҹдёҚз¬ҰеҗҲе…Ҙз»„жқЎд»¶гҖӮиЎЁ3жҳҫзӨәз ”з©¶COU-AA-302дёӯжң¬е“ҒжІ»з–—з»„вүҘ5%жӮЈиҖ…еҮәзҺ°зҡ„дё”еҸ‘з”ҹзҺҮиҫғе®үж…°еүӮз»„еўһеҠ вүҘ2%зҡ„дёҚиүҜеҸҚеә”гҖӮжң¬е“ҒиҒ”еҗҲжіје°јжқҫзҡ„дёӯдҪҚжІ»з–—ж—¶й—ҙжҳҜ13.8дёӘжңҲгҖӮ
иЎЁ3 з ”з©¶COU-AA-302дёӯйҶӢй…ёйҳҝжҜ”зү№йҫҷз»„еҸ‘з”ҹзҺҮвүҘ5%дё”иҫғе®үж…°еүӮз»„й«ҳвүҘ2%зҡ„дёҚиүҜеҸҚеә”

иЎЁ4жҳҫзӨәдәҶз ”з©¶COU-AA-302дёӯеҸ‘з”ҹзҺҮ15%д»ҘдёҠпјҢдё”жң¬е“ҒжІ»з–—з»„еҸ‘з”ҹзҺҮжҜ”е®үж…°еүӮз»„жӣҙй«ҳпјҲ>5%пјүзҡ„е®һйӘҢе®ӨжЈҖжҹҘејӮеёёгҖӮ
иЎЁ4 з ”з©¶COU-AA-302дёӯйҶӢй…ёйҳҝжҜ”зү№йҫҷз»„еҸ‘з”ҹзҺҮ>15%дё”жҜ”е®үж…°еүӮз»„й«ҳ>5%зҡ„е®һйӘҢе®ӨжЈҖжҹҘејӮеёё

з ”з©¶212082PCR 3011пјҡжІ»з–—й«ҳеҚұmHSPCжӮЈиҖ…
з ”з©¶212082PCR 3011жӢӣеӢҹдәҶ1199дҫӢж—ўеҫҖжңӘжҺҘеҸ—иҝҮз»ҶиғһжҜ’жҖ§еҢ–з–—зҡ„ж–°иҜҠж–ӯй«ҳеҚұmHSPCжӮЈиҖ…гҖӮжҺ’йҷӨдјҙжңүиӮқиҪ¬з§»зҡ„жӮЈиҖ…пјҢASTе’Ң/жҲ–ALTвүҘ2.5еҖҚULNзҡ„жӮЈиҖ…д№ҹдёҚз¬ҰеҗҲе…Ҙз»„жқЎд»¶гҖӮжүҖжңүжӮЈиҖ…еқҮеңЁиҜ•йӘҢжңҹй—ҙжҺҘеҸ—GnRHaжҲ–ж—ўеҫҖжҺҘеҸ—иҝҮеҸҢдҫ§зқҫдёёеҲҮйҷӨжңҜгҖӮжң¬е“ҒиҒ”еҗҲжіје°јжқҫзҡ„дёӯдҪҚжІ»з–—ж—¶й—ҙдёә24дёӘжңҲгҖӮ
иЎЁ5жҳҫзӨәдәҶжң¬е“ҒиҒ”еҗҲжіје°јжқҫз»„вүҘ5%жӮЈиҖ…еҮәзҺ°зҡ„дё”е…¶еҸ‘з”ҹзҺҮиҫғе®үж…°еүӮиҒ”еҗҲжіје°јжқҫз»„зҡ„еҸ‘з”ҹзҺҮеўһеҠ вүҘ2%зҡ„дёҚиүҜеҸҚеә”гҖӮ

иЎЁ6жҳҫзӨәдәҶз ”з©¶212082PCR 3011дёӯеҸ‘з”ҹзҺҮеңЁ15%д»ҘдёҠдё”жң¬е“ҒиҒ”еҗҲжіје°јжқҫжІ»з–—з»„дёӯеҸ‘з”ҹзҺҮжҜ”е®үж…°еүӮз»„жӣҙй«ҳпјҲ>5%пјүзҡ„е®һйӘҢе®ӨжЈҖжҹҘејӮеёёдәӢ件гҖӮ
![яъiлҹй§ъiІЪиһ�м¶ә'ғъiЬ#”�
фФ�H=�·УMB9@�ЯMҖ�ғС;}4ЫmvУНҸ �фЧ^Қ`p� Ӯ��е��}5���DнфУR�!]өЫO6<$wУ]B9@�ЯMҖ�ғС;}4Ық�
1§DvҡҶ·ҹ](/bzlteam_shopamdin/styles/plug/kingeditor/attached/image/20190802/20190802091956_74994.jpg) зі–е°ҝз—…гҖҒеҝғиӮҢжў—жӯ»гҖҒи„‘иЎҖз®Ўж„ҸеӨ–е’ҢеҝғжәҗжҖ§зҢқжӯ»жңүе…ігҖӮ
зі–е°ҝз—…гҖҒеҝғиӮҢжў—жӯ»гҖҒи„‘иЎҖз®Ўж„ҸеӨ–е’ҢеҝғжәҗжҖ§зҢқжӯ»жңүе…ігҖӮ
еңЁдә”йЎ№йҡҸжңәгҖҒе®үж…°еүӮеҜ№з…§дёҙеәҠз ”з©¶зҡ„жұҮжҖ»ж•°жҚ®дёӯпјҢжң¬е“ҒжІ»з–—з»„еҝғеҠӣиЎ°з«ӯзҡ„еҸ‘з”ҹзҺҮжҜ”е®үж…°еүӮз»„й«ҳпјҲ2.6% vs 0.9%пјүгҖӮжң¬е“ҒжІ»з–—з»„дёӯ1.3%зҡ„жӮЈиҖ…еҮәзҺ°3-4зә§еҝғеҠӣиЎ°з«ӯпјҢеҜјиҮҙ5дҫӢжӮЈиҖ…еҒңжӯўжІ»з–—пјҢ4дҫӢжӮЈиҖ…жӯ»дәЎгҖӮе®үж…°еүӮз»„дёӯ0.2%зҡ„жӮЈиҖ…еҮәзҺ°3-4зә§еҝғеҠӣиЎ°з«ӯгҖӮе®үж…°еүӮз»„еҮәзҺ°2дҫӢеӣ еҝғеҠӣиЎ°з«ӯиҖҢжӯ»дәЎпјҢжІЎжңүеҮәзҺ°жІ»з–—з»ҲжӯўдәӢ件гҖӮ
еңЁдёҠиҝ°жұҮжҖ»ж•°жҚ®дёӯпјҢжҠҘе‘Ҡзҡ„еҝғеҫӢеӨұеёёз»қеӨ§еӨҡж•°еұһдәҺ1-2зә§гҖӮжң¬е“ҒжІ»з–—з»„жңү1дҫӢдёҺеҝғеҫӢеӨұеёёжңүе…ізҡ„жӯ»дәЎе’Ң3дҫӢзҢқжӯ»дәӢ件пјҢе®үж…°еүӮз»„еҮәзҺ°5дҫӢзӣёе…іжӯ»дәЎдәӢ件гҖӮжң¬е“ҒжІ»з–—з»„жңү7дҫӢеӣ еҝғи·іе‘јеҗёйӘӨеҒңеҜјиҮҙзҡ„жӯ»дәЎдәӢ件пјҲ0.3%пјүпјҢе®үж…°еүӮз»„жңү2дҫӢпјҲ0.1%пјүгҖӮе®үж…°еүӮз»„жңү3дҫӢжӮЈиҖ…еӣ еҮәзҺ°еҝғиӮҢзјәиЎҖжҲ–еҝғиӮҢжў—жӯ»еҜјиҮҙжӯ»дәЎпјҢжң¬е“ҒжІ»з–—з»„жңү3дҫӢгҖӮ
д»ҘдёӢеҶ…е®№еңЁиҜҙжҳҺд№Ұзҡ„гҖҗжіЁж„ҸдәӢйЎ№гҖ‘дёӯиҜҰз»Ҷи®Ёи®әпјҡ
в—Ҹзӣҗзҡ®иҙЁжҝҖзҙ иҝҮйҮҸеј•иө·зҡ„й«ҳиЎҖеҺӢгҖҒдҪҺй’ҫиЎҖз—Үе’ҢдҪ“ж¶ІжҪҙз•ҷ
в—ҸиӮҫдёҠи…әзҡ®иҙЁеҠҹиғҪдёҚе…Ё
в—ҸиӮқжҜ’жҖ§
в—ҸйЈҹзү©еҸҜеўһеҠ жң¬е“ҒжҡҙйңІйҮҸ
дёҠеёӮеҗҺз»ҸйӘҢ
еңЁжң¬е“Ғжү№еҮҶдёҠеёӮеҗҺзҡ„дҪҝз”Ёжңҹй—ҙпјҢеҹәдәҺиҮӘеҸ‘жҠҘе‘Ҡе·ІеҸ‘зҺ°дёӢеҲ—е…¶д»–зҡ„дёҚиүҜеҸҚеә”гҖӮйў‘зҺҮеҰӮдёӢпјҡдёҚеёёи§ҒвүҘ1/1000дё”пјң1/100пјҢзҪ•и§ҒвүҘ1/10000дё”пјң1/1000гҖӮ
зі»з»ҹеҷЁе®ҳеҲҶзұ»пјҡе‘јеҗёзі»з»ҹпјҢиғёеҸҠзәөйҡ”з–ҫз—…
зҪ•и§ҒпјҡиҝҮж•ҸжҖ§иӮәжіЎзӮҺ
зі»з»ҹеҷЁе®ҳеҲҶзұ»пјҡеҗ„з§ҚиӮҢиӮүйӘЁйӘјеҸҠз»“зј”з»„з»Үз–ҫз—…
дёҚеёёи§ҒпјҡжЁӘзә№иӮҢжә¶и§ЈпјҢиӮҢз—…
зі»з»ҹеҷЁе®ҳеҲҶзұ»пјҡиӮқиғҶзі»з»ҹз–ҫз—…
зҪ•и§ҒпјҡжҡҙеҸ‘жҖ§иӮқзӮҺпјҢжҖҘжҖ§иӮқиЎ°з«ӯ
жҠҘе‘ҠеҸҜз–‘зҡ„дёҚиүҜеҸҚеә”
иҚҜе“ҒиҺ·еҫ—дёҠеёӮи®ёеҸҜеҗҺпјҢжҠҘе‘ҠеҸҜз–‘зҡ„дёҚиүҜеҸҚеә”йқһеёёйҮҚиҰҒгҖӮиҝҷж ·еҸҜд»ҘжҢҒз»ӯзӣ‘жөӢиҚҜе“Ғзҡ„иҺ·зӣҠ/йЈҺйҷ©е№іиЎЎгҖӮиҰҒжұӮеҢ»з–—дё“дёҡдәәеЈ«йҖҡиҝҮеӣҪ家дёҚиүҜеҸҚеә”жҠҘе‘Ҡзі»з»ҹжҠҘе‘Ҡд»»дҪ•еҸҜз–‘зҡ„дёҚиүҜеҸҚеә”гҖӮ
гҖҗзҰҒеҝҢгҖ‘
еҜ№жң¬е“Ғжҙ»жҖ§жҲҗеҲҶжҲ–иҫ…ж–ҷеӯҳеңЁи¶…ж•ҸеҸҚеә”иҖ…зҰҒз”ЁгҖӮ
еҰҠеЁ жҲ–жңүеҰҠеЁ еҸҜиғҪзҡ„еҰҮеҘізҰҒз”ЁгҖӮ
дёҘйҮҚиӮқеҠҹиғҪжҚҹе®іжӮЈиҖ…пјҲChild-Pugh Cзә§пјүзҰҒз”ЁгҖӮ
гҖҗжіЁж„ҸдәӢйЎ№гҖ‘
з”ұзӣҗзҡ®иҙЁжҝҖзҙ иҝҮйҮҸеҜјиҮҙзҡ„й«ҳиЎҖеҺӢгҖҒдҪҺй’ҫиЎҖз—Үе’ҢдҪ“ж¶ІжҪҙз•ҷ
з”ұдәҺжң¬е“ҒеҜ№CYP17зҡ„жҠ‘еҲ¶дҪңз”ЁдјҡеҜјиҮҙзӣҗзҡ®иҙЁжҝҖзҙ ж°ҙе№іеҚҮй«ҳпјҢеӣ жӯӨеҸҜиғҪдјҡеј•иө·й«ҳиЎҖеҺӢгҖҒдҪҺй’ҫиЎҖз—Үе’ҢдҪ“ж¶ІжҪҙз•ҷгҖӮиҮіе°‘жҜҸжңҲзӣ‘жөӢдёҖж¬ЎжӮЈиҖ…жҳҜеҗҰеҮәзҺ°й«ҳиЎҖеҺӢгҖҒдҪҺй’ҫиЎҖз—Үе’Ңж¶ІдҪ“жҪҙз•ҷгҖӮеңЁжң¬е“ҒжІ»з–—еүҚе’ҢжІ»з–—жңҹй—ҙеә”жҺ§еҲ¶й«ҳиЎҖеҺӢ并зә жӯЈдҪҺй’ҫиЎҖз—ҮгҖӮ
ж №жҚ®еӣӣйЎ№дҪҝз”Ёжіје°јжқҫ5 mgжҜҸж—ҘдёӨж¬ЎиҒ”з”ЁйҶӢй…ёйҳҝжҜ”зү№йҫҷ1000 mgжҜҸж—ҘдёҖж¬Ўзҡ„е®үж…°еүӮеҜ№з…§иҜ•йӘҢзҡ„жұҮжҖ»ж•°жҚ®пјҢеҸ‘зҺ°жң¬е“ҒжІ»з–—з»„жңү4пј…зҡ„жӮЈиҖ…е’Ңе®үж…°еүӮз»„жңү2пј…зҡ„жӮЈиҖ…еҸ‘з”ҹ3-4зә§дҪҺй’ҫиЎҖз—ҮгҖӮеҸ‘зҺ°еҗ„жІ»з–—з»„еқҮжңү2пј…зҡ„жӮЈиҖ…еҸ‘з”ҹ3-4зә§й«ҳиЎҖеҺӢпјҢеҗ„жІ»з–—з»„еқҮжңү1пј…жӮЈиҖ…еҸ‘з”ҹ3-4зә§ж¶ІдҪ“жҪҙз•ҷгҖӮ
еңЁ212082PCR 3011з ”з©¶дёӯпјҢдҪҝз”Ёжіје°јжқҫ5 mgжҜҸж—ҘдёҖж¬ЎиҒ”з”ЁйҶӢй…ёйҳҝжҜ”зү№йҫҷ1000 mgжҜҸж—ҘдёҖж¬ЎпјҢеҸ‘зҺ°жң¬е“ҒжІ»з–—з»„жңү10пј…зҡ„жӮЈиҖ…д»ҘеҸҠе®үж…°еүӮз»„жңү1пј…зҡ„жӮЈиҖ…еҮәзҺ°3-4зә§дҪҺй’ҫиЎҖз—ҮпјҢжңү20пј…зҡ„жӮЈиҖ…е’Ңе®үж…°еүӮз»„жңү10пј…зҡ„жӮЈиҖ…и§ӮеҜҹеҲ°еҸ‘з”ҹ3-4зә§й«ҳиЎҖеҺӢгҖӮеҗ„жІ»з–—з»„еқҮжңү1пј…зҡ„жӮЈиҖ…еҸ‘з”ҹ3-4зә§ж¶ІдҪ“жҪҙз•ҷгҖӮ
еҜ№дәҺиЎҖеҺӢеҚҮй«ҳгҖҒдҪҺй’ҫе’ҢдҪ“ж¶ІжҪҙз•ҷеҸҜиғҪеҜјиҮҙеҹәзЎҖз—…жғ…еҠ йҮҚзҡ„жӮЈиҖ…пјҢеҰӮжңүеҝғиЎ°гҖҒиҝ‘жңҹеҸ‘з”ҹеҝғиӮҢжў—еЎһгҖҒеҝғиЎҖз®Ўз–ҫз—…жҲ–е®ӨжҖ§еҝғеҫӢеӨұеёёзҡ„жӮЈиҖ…пјҢдҪҝз”Ёжң¬е“Ғж—¶еә”еҜҶеҲҮзӣ‘жөӢгҖӮдёҙеәҠз ”з©¶дёӯжҺ’йҷӨдәҶе·Ұе®Өе°„иЎҖеҲҶж•°пјҲLVEFпјү<50%жҲ–NYHAеҝғеҠҹиғҪIIIзә§жҲ–IVзә§еҝғиЎ°жӮЈиҖ…пјҲз ”з©¶COU-AA-301пјүжҲ–NYHAеҝғеҠҹиғҪIIзә§иҮіIVзә§еҝғиЎ°жӮЈиҖ…пјҲз ”з©¶COU-AA-302е’Ңз ”з©¶212082PCR3011пјүпјҢжң¬е“ҒеңЁиҝҷдәӣжӮЈиҖ…дёӯдҪҝз”Ёзҡ„е®үе…ЁжҖ§е°ҡдёҚзЎ®е®ҡпјҲи§ҒгҖҗдёҙеәҠиҜ•йӘҢгҖ‘пјүгҖӮ
иӮҫдёҠи…әзҡ®иҙЁеҠҹиғҪдёҚе…Ё
дә”йЎ№йҡҸжңәгҖҒе®үж…°еүӮеҜ№з…§дёҙеәҠиҜ•йӘҢжұҮжҖ»ж•°жҚ®жҳҫзӨәпјҢиӮҫдёҠи…әзҡ®иҙЁеҠҹиғҪдёҚе…Ёзҡ„еҸ‘з”ҹзҺҮеңЁжң¬е“ҒжІ»з–—з»„2230дҫӢжӮЈиҖ…е’Ңе®үж…°еүӮз»„1763дҫӢжӮЈиҖ…еҲҶеҲ«дёә0.3%е’Ң0.1%гҖӮе·ІжҠҘе‘ҠжҺҘеҸ—жң¬е“ҒиҒ”еҗҲжіје°јжқҫжІ»з–—зҡ„жӮЈиҖ…еңЁеҒңз”ЁжҜҸж—Ҙзҡ„зұ»еӣәйҶҮе’Ң/жҲ–дјҙеҸ‘ж„ҹжҹ“жҲ–еә”жҝҖзҠ¶жҖҒж—¶пјҢеҮәзҺ°иӮҫдёҠи…әзҡ®иҙЁеҠҹиғҪдёҚе…ЁгҖӮзӣ‘жөӢиӮҫдёҠи…әзҡ®иҙЁеҠҹиғҪдёҚе…Ёзҡ„з—ҮзҠ¶е’ҢдҪ“еҫҒпјҢе°Өе…¶жҳҜеҜ№дәҺеҒңз”Ёжіје°јжқҫгҖҒйҷҚдҪҺжіје°јжқҫеүӮйҮҸжҲ–еҮәзҺ°ејӮеёёеә”жҝҖзҠ¶жҖҒзҡ„жӮЈиҖ…гҖӮжң¬е“ҒжІ»з–—еҜјиҮҙзҡ„зӣҗзҡ®иҙЁжҝҖзҙ иҝҮйҮҸзӣёе…ізҡ„дёҚиүҜеҸҚеә”еҸҜиғҪдјҡжҺ©зӣ–иӮҫдёҠи…әзҡ®иҙЁеҠҹиғҪдёҚе…Ёзҡ„з—ҮзҠ¶е’ҢдҪ“еҫҒгҖӮж №жҚ®дёҙеәҠйңҖиҰҒиҝӣиЎҢйҖӮеҪ“зҡ„жЈҖжҹҘпјҢд»ҘзЎ®иҜҠиӮҫдёҠи…әзҡ®иҙЁеҠҹиғҪдёҚе…ЁгҖӮеҮәзҺ°еә”жҝҖжғ…еҶөд№ӢеүҚгҖҒжңҹй—ҙе’Ңд№ӢеҗҺеҸҜиғҪиҰҒеўһеҠ зҡ®иҙЁзұ»еӣәйҶҮеүӮйҮҸгҖӮ
иӮқжҜ’жҖ§
дә”йЎ№йҡҸжңәдёҙеәҠиҜ•йӘҢжұҮжҖ»ж•°жҚ®жҳҫзӨәпјҢ3/4зә§ALTжҲ–ASTеҚҮй«ҳпјҲиҮіе°‘5Г—ULNпјүеңЁжң¬е“ҒжІ»з–—зҡ„2230дҫӢжӮЈиҖ…дёӯеҸ‘з”ҹзҺҮдёә6%пјҢйҖҡеёёеҸ‘з”ҹеңЁжІ»з–—ејҖе§ӢеҗҺеүҚ3дёӘжңҲгҖӮзӣёжҜ”еҹәзәҝиӮқеҠҹиғҪжӯЈеёёзҡ„жӮЈиҖ…пјҢеҹәзәҝALTжҲ–ASTеҚҮй«ҳзҡ„жӮЈиҖ…жӣҙжңүеҸҜиғҪеҮәзҺ°иӮқеҠҹиғҪжҢҮж ҮеҚҮй«ҳгҖӮжң¬е“ҒжІ»з–—з»„2230дҫӢжӮЈиҖ…дёӯзәҰ1.1%зҡ„жӮЈиҖ…еӣ ALTе’ҢASTеҚҮй«ҳжҲ–иӮқеҠҹиғҪејӮеёёиҖҢеҒңжӯўжІ»з–—гҖӮеңЁиҝҷдәӣдёҙеәҠиҜ•йӘҢдёӯпјҢжңӘжҠҘе‘ҠдёҺжң¬е“ҒжҳҺзЎ®зӣёе…ізҡ„иӮқжҜ’жҖ§еҜјиҮҙзҡ„жӯ»дәЎжЎҲдҫӢгҖӮ
дәҺејҖе§Ӣжң¬е“ҒжІ»з–—еүҚгҖҒжІ»з–—ејҖе§ӢеҗҺеүҚ3дёӘжңҲеҶ…жҜҸ2е‘Ё1ж¬ЎгҖҒд»ҘеҸҠе…¶еҗҺжҜҸжңҲ1ж¬Ўзӣ‘жөӢиЎҖжё…иҪ¬ж°Ёй…¶пјҲALTе’ҢASTпјүе’ҢиғҶзәўзҙ ж°ҙе№ігҖӮеҜ№дәҺеҹәзәҝдёӯеәҰиӮқеҠҹиғҪжҚҹе®іиҖҢжҺҘеҸ—250mgзҡ„дҪҺеүӮйҮҸжІ»з–—зҡ„жӮЈиҖ…пјҢдәҺејҖе§ӢжІ»з–—еүҚгҖҒ治疗第1дёӘжңҲеҶ…жҜҸе‘Ё1ж¬ЎгҖҒйҡҸеҗҺ2дёӘжңҲеҶ…жҜҸ2е‘Ё1ж¬ЎгҖҒд»ҘеҸҠд№ӢеҗҺзҡ„жҜҸжңҲ1ж¬Ўзӣ‘жөӢALTгҖҒASTе’ҢиғҶзәўзҙ ж°ҙе№ігҖӮеҰӮжһңеҮәзҺ°жҸҗзӨәиӮқжҜ’жҖ§зҡ„дёҙеәҠз—ҮзҠ¶жҲ–дҪ“еҫҒпјҢйЎ»еҸҠж—¶зӣ‘жөӢиЎҖжё…жҖ»иғҶзәўзҙ гҖҒASTе’ҢALTж°ҙе№ігҖӮеҰӮASTгҖҒALTжҲ–иғҶзәўзҙ иҫғеҹәзәҝеҖјеҚҮй«ҳпјҢйЎ»еўһеҠ зӣ‘жөӢйў‘зҺҮгҖӮдёҖж—ҰASTжҲ–ALTеҚҮй«ҳиҮі5Г—ULNд»ҘдёҠпјҢжҲ–иғҶзәўзҙ еҚҮй«ҳиҮі3Г—ULNд»ҘдёҠпјҢйЎ»жҡӮж—¶дёӯж–ӯжң¬е“Ғ并еҜҶеҲҮзӣ‘жөӢиӮқеҠҹиғҪгҖӮ
д»…еңЁиӮқеҠҹиғҪжЈҖжҹҘеҖјжҒўеӨҚиҮіжӮЈиҖ…еҹәзәҝж°ҙе№іжҲ–ASTе’ҢALTвүӨ2.5Г—ULNдё”жҖ»иғҶзәўзҙ вүӨ1.5Г—ULNеҗҺпјҢжүҚиғҪд»ҘдҪҺеүӮйҮҸж°ҙе№іеҶҚж¬ЎдҪҝз”Ёжң¬е“ҒжІ»з–—пјҲи§ҒгҖҗз”Ёжі•з”ЁйҮҸгҖ‘пјүгҖӮеҰӮжһңжІ»з–—жңҹй—ҙд»»дҪ•ж—¶й—ҙжӮЈиҖ…еҮәзҺ°дёҘйҮҚиӮқжҜ’жҖ§пјҲASTжҲ–ALTвүҘ20Г—ULNпјүпјҢеә”еҒңз”Ёжң¬е“Ғ治疗并且дёҚеҫ—еҶҚж¬ЎдҪҝз”ЁгҖӮдёҠеёӮеҗҺзҪ•жңүжҖҘжҖ§иӮқи„ҸиЎ°з«ӯгҖҒжҡҙеҸ‘жҖ§иӮқзӮҺзҡ„жҠҘйҒ“пјҢйғЁеҲҶдёәиҮҙжӯ»жҖ§зҡ„пјҲи§ҒгҖҗдёҚиүҜеҸҚеә”гҖ‘пјүгҖӮ
йЈҹзү©еҸҜеўһеҠ жң¬е“ҒжҡҙйңІйҮҸ
жң¬е“ҒйЎ»з©әи…№жңҚз”ЁгҖӮиҮіе°‘еңЁжңҚиҚҜеүҚ2е°Ҹж—¶еҸҠжңҚиҚҜеҗҺ1е°Ҹж—¶еҶ…зҰҒйЈҹгҖӮдёҺз©әи…№жңҚиҚҜзӣёжҜ”пјҢдәҺиҝӣйӨҗж—¶жңҚз”ЁеҚ•еүӮйҮҸжң¬е“ҒпјҢйҳҝжҜ”зү№йҫҷзҡ„Cmaxе’ҢAUC0-вҲһпјҲжҡҙйңІйҮҸпјүеҲҶеҲ«еўһеҠ иҮі17еҖҚе’Ң10еҖҚгҖӮеҜ№дәҺеӨҡж¬ЎдёҺйЈҹзү©еҗҢж—¶жңҚз”Ёжң¬е“Ғж—¶еҜјиҮҙзҡ„жҡҙйңІйҮҸеўһеҠ зҡ„е®үе…ЁжҖ§е°ҡжңӘиҝӣиЎҢиҜ„дј°пјҲи§ҒгҖҗдёҚиүҜеҸҚеә”гҖ‘е’ҢгҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘пјүгҖӮ
йӘЁеҜҶеәҰ
жҷҡжңҹиҪ¬з§»жҖ§еүҚеҲ—и…әзҷҢпјҲеҺ»еҠҝжҠөжҠ—жҖ§еүҚеҲ—и…әзҷҢпјүжӮЈиҖ…еҸҜиғҪеҮәзҺ°йӘЁеҜҶеәҰйҷҚдҪҺгҖӮжң¬е“ҒдёҺзі–зҡ®иҙЁжҝҖзҙ иҒ”еҗҲдҪҝз”ЁеҸҜеўһејәиҝҷз§Қж•Ҳеә”гҖӮ
ж—ўеҫҖдҪҝз”Ёй…®еә·е”‘
ж—ўеҫҖдҪҝз”Ёй…®еә·е”‘жІ»з–—зҡ„еүҚеҲ—и…әзҷҢжӮЈиҖ…пјҢе…¶зј“и§ЈзҺҮеҸҜиғҪиҫғдҪҺгҖӮ
й«ҳиЎҖзі–з—Ү
дҪҝз”Ёзі–зҡ®иҙЁжҝҖзҙ дјҡеўһеҠ й«ҳиЎҖзі–з—ҮйЈҺйҷ©пјҢеӣ жӯӨеә”з»ҸеёёжөӢйҮҸзі–е°ҝз—…жӮЈиҖ…зҡ„иЎҖзі–гҖӮ
йӘЁйӘјиӮҢеҸҚеә”
жҺҘеҸ—жң¬е“ҒжІ»з–—зҡ„жӮЈиҖ…е·ІжҠҘе‘Ҡж•°дҫӢиӮҢз—…дәӢ件гҖӮйғЁеҲҶжӮЈиҖ…еҮәзҺ°жЁӘзә№иӮҢжә¶и§ЈдјҙйҡҸиӮҫиЎ°з«ӯгҖӮеӨ§йғЁеҲҶз—…дҫӢеңЁжІ»з–—жңҹ第дёҖдёӘжңҲеҶ…еҮәзҺ°пјҢеҒңз”Ёжң¬е“ҒеҗҺеҸҜжҒўеӨҚгҖӮеҜ№еҗҲ并дҪҝз”Ёе·ІзҹҘдёҺиӮҢз—…/жЁӘзә№иӮҢжә¶и§Јжңүе…ізҡ„иҚҜзү©жІ»з–—зҡ„жӮЈиҖ…пјҢеә”ж…Һз”Ёжң¬е“ҒгҖӮ
иҒ”еҗҲеҢ–з–—жІ»з–—
жң¬е“ҒдёҺз»ҶиғһжҜ’жҖ§еҢ–з–—иҒ”еҗҲдҪҝз”Ёзҡ„е®үе…ЁжҖ§е’Ңз–—ж•Ҳе°ҡжңӘзЎ®е®ҡгҖӮ
иҫ…ж–ҷдёҚиҖҗеҸ—жҖ§
жң¬е“Ғеҗ«д№ізі–гҖӮжңүеҚҠд№ізі–дёҚиҖҗеҸ—з—ҮгҖҒLappпјҲжӢүжҷ®пјүд№ізі–й…¶зјәд№Ҹз—ҮжҲ–и‘Ўиҗ„зі–-еҚҠд№ізі–еҗёж”¶йҡңзўҚз—ҮзӯүзҪ•и§ҒйҒ—дј й—®йўҳзҡ„жӮЈиҖ…дёҚеә”жңҚз”Ёжң¬е“ҒгҖӮжң¬е“Ғиҝҳеҗ«жңүй’ пјҢжҜҸ4зүҮеүӮйҮҸзҡ„й’ еҗ«йҮҸи¶…иҝҮ1.18mmolпјҲжҲ–27mgпјүгҖӮйҷҗй’ ж‘„е…Ҙзҡ„жӮЈиҖ…еә”дәҲд»ҘиҖғиҷ‘гҖӮ
е…¶е®ғжҪңеңЁйЈҺйҷ©
иҪ¬з§»жҖ§еҺ»еҠҝжҠөжҠ—жҖ§еүҚеҲ—и…әзҷҢз”·жҖ§жӮЈиҖ…пјҲеҢ…жӢ¬жӯЈеңЁжҺҘеҸ—жң¬е“ҒжІ»з–—зҡ„жӮЈиҖ…пјүеҸҜиғҪжңүиҙ«иЎҖе’ҢжҖ§еҠҹиғҪйҡңзўҚзҡ„йЈҺйҷ©гҖӮ
иҜ·зҪ®дәҺе„ҝз«ҘдёҚжҳ“жӢҝеҲ°еӨ„гҖӮ
QTй—ҙжңҹ
еңЁдёҖйЎ№еӨҡдёӯеҝғејҖж”ҫеҚ•иҮӮдёҙеәҠиҜ•йӘҢдёӯпјҢ33дҪҚmCRPCжӮЈиҖ…еңЁиҝӣйӨҗеүҚ1е°Ҹж—¶жҲ–иҝӣйӨҗеҗҺ2е°Ҹж—¶жңҚз”Ёжң¬е“Ғ1000mgжҜҸж—Ҙ1ж¬ЎпјҢеҗҢж—¶еҗҲ并жңҚз”Ёжіје°јжқҫ5mgжҜҸж—Ҙ2ж¬ЎгҖӮзӣҙеҲ°з¬¬2е‘Ёжңҹзҡ„第2еӨ©QTcй—ҙжңҹиҫғеҹәзәҝж— жҳҫи‘—еҸҳеҢ–пјҲеҰӮ>20msпјүгҖӮ然иҖҢпјҢз”ұдәҺдёҙеәҠиҜ•йӘҢи®ҫи®Ўзҡ„еұҖйҷҗжҖ§пјҢдёҚиғҪе®Ңе…ЁжҺ’йҷӨжң¬е“ҒеҸҜиғҪе°Ҹ幅延й•ҝQTcй—ҙжңҹпјҲеҰӮ<10msпјүгҖӮ
еҜ№й©ҫ驶е’Ңж“ҚдҪңжңәеҷЁиғҪеҠӣзҡ„еҪұе“Қ
жң¬е“ҒеҜ№й©ҫ驶е’Ңж“ҚдҪңжңәеҷЁиғҪеҠӣж— еҪұе“ҚжҲ–еҪұе“ҚеҸҜеҝҪз•ҘдёҚи®ЎгҖӮ
гҖҗеӯ•еҰҮеҸҠе“әд№іжңҹеҰҮеҘіз”ЁиҚҜгҖ‘
еҰҠеЁ
жң¬е“ҒдёҚйҖӮз”ЁдәҺеҘіжҖ§гҖӮеҹәдәҺжң¬е“Ғзҡ„дҪңз”ЁжңәеҲ¶е’ҢеңЁеҠЁзү©иҜ•йӘҢзҡ„з»“жһңпјҢеҰҠеЁ жҲ–жңүеҰҠеЁ еҸҜиғҪзҡ„еҰҮеҘізҰҒз”Ёжң¬е“ҒпјҢеӣ дёәжң¬е“ҒеҸҜиғҪдјҡеҜјиҮҙиғҺе„ҝжҚҹе®іпјҢ并еҸҜиғҪеј•иө·еҰҠеЁ дёӯжӯўгҖӮ
е°ҡж— е…ідәҺеӯ•еҰҮдҪҝз”Ёжң¬е“Ғзҡ„дәәдҪ“ж•°жҚ®гҖӮеңЁеҠЁзү©з”ҹж®–иҜ•йӘҢдёӯпјҢеҰҠеЁ еӨ§йј еңЁеҷЁе®ҳеҪўжҲҗйҳ¶ж®өеҸЈжңҚйҶӢй…ёйҳҝжҜ”зү№йҫҷпјҢеҪ“жҜҚдҪ“жҡҙйңІйҮҸзәҰдёәдәәдҪ“жҺЁиҚҗеүӮйҮҸдёӢжҡҙйңІйҮҸпјҲAUCпјүзҡ„вүҘ0.03еҖҚж—¶пјҢеҜ№иғҺд»”зҡ„еҸ‘иӮІжңүеҪұе“ҚгҖӮ
е“әд№і
жң¬е“ҒдёҚйҖӮз”ЁдәҺеҘіжҖ§гҖӮе°ҡдёҚзЎ®е®ҡжң¬е“ҒжҳҜеҗҰдјҡеҲҶжіҢеҲ°жҜҚд№ідёӯпјҢд»ҘеҸҠжң¬е“ҒеҜ№д№іжұҒеҲҶжіҢд»ҘеҸҠжҜҚд№іе–Ӯе…»е©ҙе„ҝзҡ„еҪұе“ҚгҖӮ
йҒҝеӯ•
зӣ®еүҚе°ҡдёҚжё…жҘҡйҳҝжҜ”зү№йҫҷжҲ–е…¶д»Ји°ўзү©жҳҜеҗҰеӯҳеңЁдәҺзІҫж¶ІдёӯгҖӮеҰӮжһңжӮЈиҖ…дёҺеӯ•еҰҮеҸ‘з”ҹжҖ§иЎҢдёәпјҢеҲҷйңҖиҰҒдҪҝз”ЁйҒҝеӯ•еҘ—гҖӮеҰӮжһңжӮЈиҖ…дёҺиӮІйҫ„жңҹеҘіжҖ§еҸ‘з”ҹжҖ§иЎҢдёәпјҢеҲҷиҰҒжұӮдҪҝз”ЁйҒҝеӯ•еҘ—еҗҢж—¶иҝҳйңҖдҪҝз”ЁеҸҰеӨ–дёҖз§Қжңүж•Ҳзҡ„йҒҝеӯ•ж–№ејҸгҖӮ
ж №жҚ®еҠЁзү©з”ҹж®–иҜ•йӘҢзҡ„з»“жһңеҸҠе…¶дҪңз”ЁжңәеҲ¶пјҢеҰӮжһңз”·жҖ§зҡ„дјҙдҫЈдёәиӮІйҫ„еҘіжҖ§пјҢеҲҷе»әи®®е…¶еңЁжң¬е“ҒжІ»з–—жңҹй—ҙе’Ңжң«ж¬Ўз»ҷиҚҜеҗҺ3е‘ЁеҶ…йҮҮз”Ёжңүж•Ҳзҡ„йҒҝеӯ•жҺӘж–ҪгҖӮ
з”ҹиӮІеҠӣ
ж №жҚ®еҠЁзү©иҜ•йӘҢпјҢжң¬е“ҒеҸҜиғҪдјҡжҚҹе®іиӮІйҫ„з”·жҖ§зҡ„з”ҹиӮІиғҪеҠӣгҖӮ
гҖҗе„ҝз«Ҙз”ЁиҚҜгҖ‘
е°ҡжңӘзЎ®е®ҡжң¬е“Ғз”ЁдәҺе„ҝз«Ҙзҡ„жңүж•ҲжҖ§е’Ңе®үе…ЁжҖ§гҖӮ
гҖҗиҖҒе№ҙз”ЁиҚҜгҖ‘
еңЁжң¬е“ҒдёҙеәҠиҜ•йӘҢжҺҘеҸ—жң¬е“ҒжІ»з–—зҡ„жӮЈиҖ…дёӯпјҢ70%зҡ„жӮЈиҖ…дёә65еІҒжҲ–65еІҒд»ҘдёҠпјҢиҖҢ27%зҡ„жӮЈиҖ…дёә75еІҒжҲ–75еІҒд»ҘдёҠгҖӮиҖҒе№ҙжӮЈиҖ…е’Ңиҫғе№ҙиҪ»жӮЈиҖ…еңЁе®үе…ЁжҖ§е’Ңжңүж•ҲжҖ§дёҠжІЎжңүи§ӮеҜҹеҲ°жҖ»дҪ“е·®ејӮгҖӮе°ҡжІЎжңүе…¶д»–зҡ„дёҙеәҠжҠҘе‘ҠиҜҒе®һиҖҒе№ҙжӮЈиҖ…е’Ңиҫғе№ҙиҪ»жӮЈиҖ…еҜ№жң¬е“Ғзҡ„еә”зӯ”жңүе·®ејӮпјҢдҪҶжҳҜдёҚиғҪжҺ’йҷӨиҖҒе№ҙжӮЈиҖ…ж•Ҹж„ҹжҖ§жӣҙй«ҳгҖӮ
гҖҗиҚҜзү©зӣёдә’дҪңз”ЁгҖ‘
дёҺе…¶д»–иҚҜзү©зҡ„зӣёдә’дҪңз”Ё
е…¶д»–иҚҜзү©еҜ№йҳҝжҜ”зү№йҫҷжҡҙйңІйҮҸзҡ„жҪңеңЁеҪұе“Қ
ж №жҚ®дҪ“еӨ–ж•°жҚ®пјҢжң¬е“ҒжҳҜCYP3A4зҡ„еә•зү©гҖӮеңЁдёҖйЎ№еҒҘеә·еҸ—иҜ•иҖ…зҡ„иҚҜд»ЈеҠЁеҠӣеӯҰзӣёдә’дҪңз”ЁдёҙеәҠз ”з©¶дёӯпјҢеҸ—иҜ•иҖ…е…ҲжҺҘеҸ—ејәж•ҲCYP3A4иҜұеҜјеүӮеҲ©зҰҸе№із»ҷиҚҜпјҢжҜҸеӨ©600 mgпјҢжҢҒз»ӯ6еӨ©пјҢйҡҸеҗҺжҺҘеҸ—1,000 mgжң¬е“ҒеҚ•еүӮйҮҸз»ҷиҚҜпјҢйҳҝжҜ”зү№йҫҷиЎҖжөҶAUCвҲһеқҮеҖјдёӢйҷҚ55%гҖӮ
жІ»з–—жңҹй—ҙеә”йҒҝе…ҚдҪҝз”Ёејәж•ҲCYP3A4иҜұеҜјеүӮпјҲеҰӮпјҢиӢҜеҰҘиӢұй’ гҖҒеҚЎй©¬иҘҝе№ігҖҒеҲ©зҰҸе№ігҖҒеҲ©зҰҸеёғжұҖгҖҒеҲ©зҰҸе–·дёҒгҖҒиӢҜе·ҙжҜ”еҰҘгҖҒеңЈзәҰзҝ°иҚү[иҙҜеҸ¶иҝһзҝҳ]пјүпјҢйҷӨйқһжІЎжңүе…¶д»–жӣҝд»ЈжІ»з–—ж–№жЎҲгҖӮ
еңЁеҸҰдёҖйЎ№еҒҘеә·еҸ—иҜ•иҖ…зҡ„иҚҜд»ЈеҠЁеҠӣеӯҰзӣёдә’дҪңз”ЁдёҙеәҠз ”з©¶дёӯпјҢдёҺй…®еә·е”‘пјҲдёҖз§Қејәж•ҲCYP3A4жҠ‘еҲ¶еүӮпјүиҒ”еҗҲдҪҝз”ЁжңӘеҜ№йҳҝжҜ”зү№йҫҷзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰдә§з”ҹе…·жңүдёҙеәҠж„Ҹд№үзҡ„еҪұе“ҚгҖӮ
йҳҝжҜ”зү№йҫҷеҜ№е…¶д»–иҚҜзү©жҡҙйңІйҮҸзҡ„жҪңеңЁеҪұе“Қ
йҳҝжҜ”зү№йҫҷжҳҜиӮқи„ҸиҚҜзү©д»Ји°ўй…¶CYP2D6е’ҢCYP2C8зҡ„жҠ‘еҲ¶еүӮгҖӮ
еңЁз ”究жң¬е“ҒпјҲеҠ жіје°јжқҫпјүеҚ•еүӮйҮҸз»ҷиҚҜеҜ№CYP2D6еә•зү©еҸізҫҺжІҷиҠ¬еҪұе“Қзҡ„дёҖйЎ№иҜ•йӘҢдёӯпјҢеҸізҫҺжІҷиҠ¬зҡ„е…Ёиә«жҡҙйңІйҮҸпјҲAUCпјүеўһеҠ дәҶзәҰ2.9еҖҚгҖӮеҸізҫҺжІҷиҠ¬зҡ„жҙ»жҖ§д»Ји°ўзү©еҸіе•Ўзғ·зҡ„AUC24еўһеҠ дәҶзәҰ33%гҖӮ
жң¬е“ҒдёҺз»ҸCYP2D6жҙ»еҢ–жҲ–д»Ји°ўзҡ„иҚҜзү©пјҲзү№еҲ«жҳҜжІ»з–—жҢҮж•°иҫғзӘ„зҡ„иҚҜзү©пјүиҒ”еҗҲдҪҝз”Ёж—¶йңҖи°Ёж…ҺпјҢеә”еҪ“иҖғиҷ‘йҷҚдҪҺжІ»з–—жҢҮж•°иҫғзӘ„зҡ„иҚҜзү©зҡ„еүӮйҮҸгҖӮз»ҸCYP2D6д»Ји°ўзҡ„иҚҜзү©еҢ…жӢ¬зҫҺжүҳжҙӣе°”гҖҒжҷ®иҗҳжҙӣе°”гҖҒең°жҳ”её•жҳҺгҖҒж–ҮжӢүжі•иҫӣгҖҒж°ҹе“Ң啶йҶҮгҖҒеҲ©еҹ№й…®гҖҒжҷ®зҪ—её•й…®гҖҒж°ҹеҚЎе°јгҖҒеҸҜеҫ…еӣ гҖҒзҫҹиҖғй…®гҖҒжӣІй©¬еӨҡзӯүпјҲеҗҺдёүз§ҚиҚҜе“ҒйңҖиҰҒйҖҡиҝҮCYP2D6еҪўжҲҗжҙ»жҖ§й•Үз—ӣд»Ји°ўзү©пјүгҖӮ
ж №жҚ®дёҖйЎ№еңЁеҒҘеә·еҸ—иҜ•иҖ…дёӯејҖеұ•зҡ„CYP2C8иҚҜзү©й—ҙзӣёдә’дҪңз”Ёзҡ„иҜ•йӘҢпјҢеҗЎж јеҲ—й…®дёҺжң¬е“Ғ1,000 mgеҚ•еүӮйҮҸиҒ”еҗҲз»ҷиҚҜеҗҺпјҢеҗЎж јеҲ—й…®зҡ„AUCеўһеҠ 46%пјҢеҗЎж јеҲ—й…®зҡ„жҙ»жҖ§д»Ји°ўзү©M-IIIе’ҢM-IVзҡ„AUCеҗ„йҷҚдҪҺ10%гҖӮе°Ҫз®Ўиҝҷдәӣз»“жһңжҳҫзӨәжң¬е“ҒдёҺдё»иҰҒз»ҸCYP2C8ж¶ҲйҷӨзҡ„иҚҜзү©иҒ”еҗҲдҪҝз”Ёж—¶пјҢжң¬е“ҒжҡҙйңІйҮҸзҡ„еўһеҠ дёҚе…·жңүдёҙеәҠж„Ҹд№үпјҢдҪҶдёӨз§ҚиҚҜзү©иҒ”еҗҲеә”з”Ёж—¶пјҢеә”зӣ‘жөӢжӮЈиҖ…жҳҜеҗҰдјҡеҸ‘з”ҹжІ»з–—жҢҮж•°зӘ„зҡ„CYP2C8еә•зү©еј•иө·зҡ„жҜ’жҖ§еҸҚеә”гҖӮ
дҪ“еӨ–з ”з©¶иЎЁжҳҺпјҢжң¬е“Ғзҡ„дё»иҰҒд»Ји°ўзү©зЎ«й…ёйҳҝжҜ”зү№йҫҷе’Ңж°®ж°§еҢ–зЎ«й…ёйҳҝжҜ”зү№йҫҷиғҪеӨҹжҠ‘еҲ¶иӮқи„Ҹж‘„еҸ–иҪ¬иҝҗиӣӢзҷҪOATP1B1пјҢеӣ жӯӨеҸҜиғҪеўһеҠ з»ҸOATP1B1ж¶ҲйҷӨзҡ„иҚҜзү©зҡ„жө“еәҰгҖӮеҹәдәҺиҪ¬иҝҗиӣӢзҷҪзҡ„иҚҜзү©зӣёдә’дҪңз”Ёе°ҡж— дёҙеәҠз ”з©¶ж•°жҚ®гҖӮ
дёҺе·ІзҹҘ延й•ҝQTй—ҙжңҹзҡ„иҚҜзү©иҒ”еҗҲдҪҝз”Ё
з”ұдәҺеҺ»еҠҝжІ»з–—еҸҜ延й•ҝQTй—ҙжңҹпјҢеӣ жӯӨжң¬е“ҒдёҺе·ІзҹҘеҸҜ延й•ҝQTй—ҙжңҹзҡ„иҚҜзү©жҲ–еҸҜд»ҘиҜұеҜје°–з«ҜжүӯиҪ¬жҖ§е®ӨжҖ§еҝғеҠЁиҝҮйҖҹзҡ„иҚҜзү©иҒ”еҗҲдҪҝз”Ёж—¶еә”и°Ёж…ҺпјҢеҰӮIAзұ»пјҲдҫӢеҰӮеҘҺе°јдёҒгҖҒдёҷеҗЎиғәпјүжҲ–IIIзұ»пјҲдҫӢеҰӮиғәзўҳй…®гҖҒзҙўд»–жҙӣе°”гҖҒеӨҡйқһеҲ©зү№гҖҒдјҠеёғеҲ©зү№пјүжҠ—еҝғеҫӢеӨұеёёиҚҜе“ҒгҖҒзҫҺжІҷй…®гҖҒиҺ«иҘҝжІҷжҳҹгҖҒжҠ—зІҫзҘһз—…иҚҜзү©зӯүгҖӮ
дёҺиһәеҶ…й…ҜиҒ”еҗҲдҪҝз”Ё
иһәеҶ…й…ҜеҸҜдёҺйӣ„жҝҖзҙ еҸ—дҪ“з»“еҗҲ并еҸҜиғҪеўһеҠ еүҚеҲ—и…әзү№ејӮжҖ§жҠ—еҺҹпјҲPSAпјүж°ҙе№ігҖӮдёҚжҺЁиҚҗдёҺжң¬е“ҒиҒ”еҗҲдҪҝз”ЁгҖӮ
гҖҗиҚҜзү©иҝҮйҮҸгҖ‘
жң¬е“ҒиҝҮйҮҸдҪҝз”Ёзҡ„з»ҸйӘҢжңүйҷҗгҖӮ
жң¬е“Ғж— зү№ејӮжҖ§и§ЈжҜ’иҚҜгҖӮеңЁеҸ‘з”ҹжңҚиҚҜиҝҮйҮҸдәӢ件时пјҢеә”еҪ“еҒңз”Ёжң¬е“ҒпјҢ并йҮҮеҸ–з»јеҗҲж”ҜжҢҒжҖ§жҺӘж–ҪпјҢеҢ…жӢ¬еҜ№еҝғеҫӢеӨұеёёгҖҒеҝғеҠӣиЎ°з«ӯзҡ„зӣ‘жөӢд»ҘеҸҠиӮқеҠҹиғҪзҡ„иҜ„д»·гҖӮ
гҖҗиҙ®и—ҸгҖ‘15~30в„ғдҝқеӯҳгҖӮ
гҖҗеҢ…иЈ…гҖ‘еҸЈжңҚеӣәдҪ“иҚҜз”Ёй«ҳеҜҶеәҰиҒҡд№ҷзғҜ瓶пјҢ60зүҮ/瓶гҖӮ
гҖҗжңүж•ҲжңҹгҖ‘24дёӘжңҲ
гҖҗз”ҹдә§дјҒдёҡгҖ‘жӯЈеӨ§еӨ©жҷҙиҚҜдёҡйӣҶеӣўиӮЎд»Ҫжңүйҷҗе…¬еҸё














 е®ҳж–№еҫ®дҝЎ
е®ҳж–№еҫ®дҝЎ
 жүӢжңәе•ҶеҹҺ
жүӢжңәе•ҶеҹҺ