【商品名】安达唐 达格列净片
【产品名称】达格列净片
【汉语拼音】DaGeLieJingPian
【主要成份】达格列净。
【性状】5mg规格:黄色,双凸,圆形薄膜衣片,一面刻有“5”,另一面刻有“1427”。
10mg规格:黄色,双凸,菱形薄膜衣片,一面刻有“10”,另一面刻有“1428”。
【功能主治】本药用于配合饮食控制和运动改善2型糖尿病患者的血糖控制。使用限制,本药不适用于1型糖尿病或糖尿病酮症酸中毒患者。
【规格】(1)5mg (2)10mg。
【用法用量】推荐剂量,推荐起始剂量为一次5mg,一日1次,早晨服用,可与或不与食物同服。对本药一次5mg,一日1次剂量耐受且须更多血糖扩指着,可增至一次10mg,一日1次。
对于血容量不足患者,建议在开始本品治疗之前纠正这种情况。(参考注意事项和老年用药)
肾功能不全患者:建议在开始本品治疗之前评估肾功能情况,并在此后定期评估。
肾小球滤过率<60ml/(min/1.73m2)患者不推荐使用本药治疗。
轻度肾功能损害者[肾小球滤过率≥60ml/(min/1.73m2)]无需调整剂量。
肾小球滤过率持续<60ml/(min/1.73m2)时应停药。
如出现eGFR低于30ml/min/1.73m2,禁止使用本品。
肝功能受损患者:对于轻度,中度或重度肝功能受损患者无需调整剂量。但是,尚未在重度肝功能受损患者中具体研究本品的安全性和疗效,因此应单独评估该人群使用本品的获益风险(参见药代动力学)。
【不良反应】低血压,酮症酸中毒,急性肾损伤和肾功能损害,尿脓毒症和肾盂肾炎,与胰岛素和胰岛素促泌剂合用引起低血糖,生殖器真菌感染,低密度脂蛋白胆固醇(LDL-C)升高,膀胱癌。
临床试验
由于临床试验是在各种不同条件下进行的,观察到的不良反应发生率不能直接与其他临床试验中的发生率相比较,可能也不能反应临床实践中观察到的发生率。
汇总12项安慰剂对照试验研究中达格列净5mg、10mg的数据
表1中的数据来源于12项安慰剂对照试验,试验时长12-24周。其中4项为本药单药治疗,另外8项为本药加入标准糖尿病治疗方案或与二甲双胍联合治疗。
这些数据放映了2338名患者接受本药治疗,平均暴露时间为21周。其中安慰剂组1393名患者、本药5mg组1145名患者、本药10mg组1193名患者,患者均接受一日1次用药。受试者平均年龄55岁,其中2%>75岁。50%为男性,81%为白种人,14%为亚洲人,3%为黑人或非暨美国人。基线水平,受试者患病平均年数为6年,糖化血红蛋白(HbA1c)平均值为8.3%,其中21%受试者出现糖尿病微血管并发症。92%受试者肾功能正常或出现轻度肾功能损害,8%受试者出现中度肾功能损害,平均肾小球滤过率为86ml/(min/1.73m2)。
达格列净常见不良反应见表1。这些不良反应并不是在基线时出现,本药较安慰剂更为常见发生程度,在本药5mg或10mg组中发现2%以上出现这些不良反应。
表1 安慰剂对照试验中≥2%达格列净治疗患者报告的不良反应。
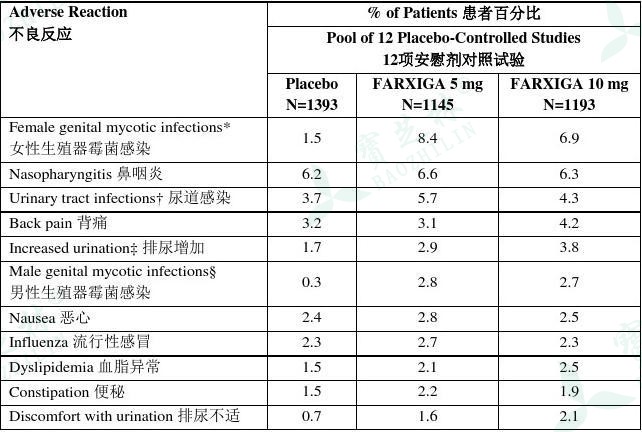
1.女性生殖器霉菌感染包括以下不良反应(按发生率排序):外阴阴道霉菌感染、阴道感染、外阴阴道念珠菌病、外阴阴道炎、生殖感染、生殖器念珠菌病、生殖器真菌感染、外阴炎、泌尿生殖道感染、外阴脓肿、细菌性阴道炎。
2.尿道感染包括以下不良反应,按发生率排序:尿道感染、膀胱炎、大肠埃希菌型尿路感染、泌尿生殖道感染、肾盂肾炎、膀胱三角炎、尿道炎、肾脏感染、前列腺炎。
3.排尿增加包括以下不良反应(按发生率排序):尿频、多尿、尿量增加。
4.男性生殖器霉菌感染包括以下不良反应(按发生率排序):龟头炎、生殖器真菌感染、龟头念珠菌病、生殖器念珠菌病、男性生殖器感染、阴茎感染、龟头包皮炎、感染性龟头包皮炎、生殖感染、包皮炎。
汇总13项达格列净10mg安慰剂对照试验合并数据
本药10mg的安全性和耐受性在一项大型安慰剂对照合并研究中进行评估。这项合并对照研究包括13项临床试验,其中3项为本药单药治疗,另外9项为本药加入标准糖尿病治疗方案或用药初期与二甲双胍合用。试验数据中,2360名患者接受本药10mg治疗,一日1次,患者平均暴露时间为22周。受试者平均年龄59岁,其中4%>75岁。58%为男性,84%为白种人,9%为亚洲人,3%为黑人或非暨美国人。基线水平,受试者患病平均年数为9年,HbA1c平均值为8.2%,其中30%受试者出现糖尿病微血管并发症。88%受试者肾功能正常或出现轻度肾功能损害,11%受试者出现中度肾功能损害,平均肾小球滤过率为82ml/(min/1.73m2)。
达格列净可引起渗透性利尿,降低血容量。12项和13项短期、安慰剂对照合并数据中与血容量不足(包括脱水、血容量减少、直立性低血压、低血压的报道)相关的不良反应见表2。
表2 达格列净临床试验中血容量不足的不良反应
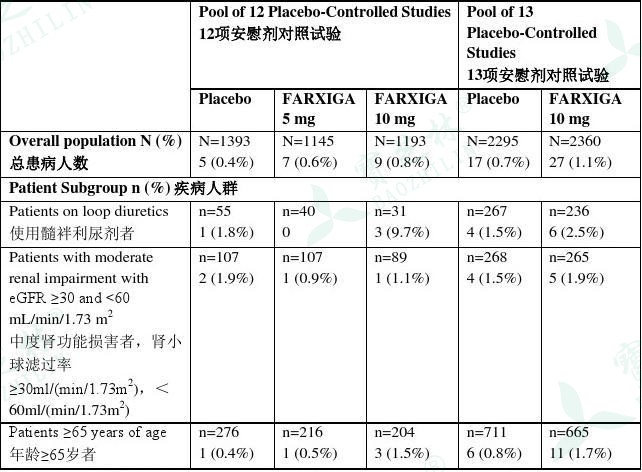
1.血容量不足包括脱水、血容量减少、直立性低血压、低血压的报道。
肾功能损害
使用达格列净可增加血清肌酸酐并降低肾小球滤过率(见表3)。基线肾功能正常或轻度肾功能损害者,用药24周后血清肌酸酐和肾小球滤过率水平回至基线值。使用本药患者出现与肾相关的不良反应(包括肾衰竭和血清肌酸酐升高)频率更高(见表4)。老年患者和肾功能损害者对此类作用更为敏感(见表4)。中度肾功能损害者[肾小球滤过率>30ml/(min/1.73m2),<60ml/(min/1.73m2)]曾出现持续的肾小球滤过率降低。
表3 本药12周临床试验中和中度肾功能损害试验中血清肌酸酐、肾小球滤过率改变
表4 至少有一项肾功能损害相关不良反应的患者比例
1.来自12项具有长期延长期的安慰剂对照试验的亚组患者。
2.来自13项具有长期延长期的安慰剂对照试验的亚组患者。
本药的安全性通过一项在中度肾功能损害者[肾小球滤过率>30ml/(min/1.73m2),<60ml/(min/1.73m2)]中的试验评估。在这项试验中,13名患者用药104周期间出现骨折,安慰剂组未出现骨折。出现骨折的13名患者中:5名为本药5mg组,8名为本药10mg组;8名为基线肾小球滤过率30-45ml/(min/1.73m2);11名用药52周内出现骨折。关于骨折解剖部位,无明显规律。
低血糖
试验中低血糖的发生率见表5,本药与磺酰脲或胰岛素合用时候更易发生低血糖。
表5 安慰剂对照试验中低血压的主要和小幅度发生率
1.低血糖主要发作定义为出现意识或行为严重损害(伴毛细血管或血浆葡萄糖值<54mg/dl)后需外界(第三方)协助的有症状发作,发作在使用葡萄糖或胰高血糖素后迅速恢复。
2.低血糖小幅度发作定义为伴毛细血管或血浆葡萄糖值<63mg/dl无需外界协助的有症状发作,或伴毛细血管或血浆葡萄糖值<63mg/dl未评价为主要发作的无症状发作。
3.OAD=口服抗糖尿病药疗法
生殖器霉菌感染
使用本药患者更易出现生殖器霉菌感染。在12项安慰剂对照试验的已有报道中,出现生殖器霉菌感染患者比例,安慰剂组为0.9%、本药5mg组为5.7%、本药10mg组为4.8%。由于生殖器霉菌感染停药患者比例,安慰剂组为0%、本药10mg组为0.2%。报道中女性感染较男性感染更为常见(见表1),最为常见的生殖器霉菌感染为女性外阴阴道霉菌感染、男性龟头炎。试验中有生殖器霉菌感染病史的患者更易出现感染。
超敏反应
使用本药治疗有出现过敏反应(如血管神经性水肿、过敏)的报道。临床研究中,出现严重过敏反应、严重皮肤不良反应、血管神经水肿患者的比例,对照组为0.2%、使用本药组为0.3%。如出现过敏反应,应停药并进行对症治疗及监测,直至迹象和症状解决。
【注意事项】低血压
达格列净可导致血管内容积收缩。采用本品开始治疗后会发生症状性低血压[见不良反应]尤其是在有肾功能 受损患者中(eGFR 低于 60 mL/min/1.73 m2),老年患者或正在服用髓袢利尿剂的患者。具有以上一种或多种特征的患者在开始本品治疗前,应评估并纠正血容量状态。治疗期间应检测低血压体征和病状。
肾功能损害
达格列净增加血清肌酐和减低 eGFR。老年患者和有受损肾功能患者可能对这些变化更敏感。开始本品治疗后会发生与肾功能相关不良反应[见不良反应)]。开始本品治疗前和其后定期应评价肾功能。
与胰岛素和胰岛素促分泌素同时使用低血糖
已知胰岛素和胰岛素促分泌素致低血糖。达格列净与胰岛素或一种胰岛素促分泌素联用时可能增加低血糖风险[见不良反应]。因此,与 达格列净合用时,应使用较低剂量的胰岛素或胰岛素促分泌剂,以降低低血糖风险。
生殖器真菌感染 达格列净会增加生殖器真菌感染的风险。有生殖器霉菌性感染史的患者更容易发生生殖器真菌感染[见不良反应]。所以应检测并给予相应治疗。
低密度脂蛋白胆固醇(LDL-C)增高
达格列净会导致 LDL-C 增高[见不良反应]。本品开始治疗后,监视 LDL-C 并按照标准治疗法治疗。
膀胱癌
22项临床研究中,10/6045例(0.17%)达格列净治疗患者和1/3512例(0.03%)(安慰剂/对照药治疗患者报告新确诊膀胱癌。剔除从药物暴露到确诊膀胱癌时间不到一年的患者后,达格列净组有4例,安慰剂/对照药组无。基线时,治疗组间膀胱癌风险因子和血尿情况(潜在肿瘤的指标)是均衡的。病例数太少从而还不能确定这些事件的出现是否与达格列净有关。
无充分数据确定达格列净对已有的膀胱肿瘤是否有影响。因此,在有活动性膀胱癌患者禁用本品。对于膀胱癌既往史患者,应权衡血糖控制获益和达格列净对癌症复发血糖控制的获益相比未知风险。
大血管病变结果
没有临床研究确定用本品或任何其他抗糖尿病药物减低大血管风险的结论性证据。
【禁忌】1.对本药有严重过敏史者。
2.重度肾功能损害、晚期肾病患者。
3.透析患者。
【孕妇及哺乳期妇女用药】
妊娠
尚未在妊娠期妇女中进行充分、严格的对照试验,基于动物生殖毒性试验结果,本药可能影响肾脏的发育和成熟。在一项大鼠幼崽研究中,给予最低测试剂量(约为人类临床暴露量10mg的15倍)可出现明显的肾盂炎和食道扩张发生率增加和(或)加重。
这些在动物发育期间使用药物暴露量出现的结果,与人类妊娠中期、妊娠晚期相关。妊娠期间,应采取替代疗法,尤其妊娠中期、妊娠晚期。本药仅在利大于弊的情况下方可用于妊娠期妇女。在一项大鼠幼崽毒性研究中,给予本药剂量为一日1mg/kg、15mg/kg、75mg/kg(于出生后21-90日期间),所有剂量组出现肾脏重量增加、肾盂炎、食道扩张。给予的最低测试剂量以曲线下面积(AUC)计,约为人类最大临床暴露量的15倍。在幼崽中出现的肾盂炎、食管扩张并未在1个月恢复期间完全恢复。
在一项大鼠出生前和出生后发育研究中,妊娠大鼠从妊娠第6日到哺乳第21日,给予本药剂量为一日1mg/kg、15mg/kg、75mg/kg,幼崽在子宫内及哺乳期间间接暴露于本药。使用每日75mg/kg组(妊娠大鼠暴露量相当于人类治疗暴露量的1415倍,幼崽暴露量相当于人类治疗暴露量的137倍)中,成年后代出现肾盂炎和食道扩张发生率增加或加重。所有组(约为临床剂量≥19倍)中幼崽出现与剂量相关的体重降低。每日1mg/kg组(约为临床剂量的19倍)中,未见发育相关不良反应。
在一项大鼠、家兔胚胎-胎仔发育研究中,间隔给予本药以保持与人类妊娠前期器官形成期一致。家兔任一剂量组未见生殖毒性。大鼠给予本药剂量达一日75mg/kg(相当于最大临床暴露量10mg的1441倍)时未见致畸作用。大鼠使用更高剂量(≥150mg/kg,相当于临床剂量10mg的2344倍)时出现血管、肋骨、椎骨、胸骨柄畸形,以及胎仔骨骼变化。
哺乳
本药是否随人类乳汁排泄尚不明确。本药可随大鼠乳汁排泄(为母体浓度的0.49倍)。直接暴露于本药后的大鼠幼崽,可见肾脏发育风险(肾盂炎和食道扩张)。由于人类肾脏发育在母体子宫内以及出生后2年(需哺乳),可能有药物暴露对人类肾脏发育有风险。由于许多药物都可随人类乳汁排泄,且本药哺乳时造成严重不良反应的可能性,哺乳期妇女用药应权衡利弊,应考虑停药或停止哺乳。
【儿童用药】18岁以下儿童使用本药的安全性和有效性尚不明确。
【老人用药】尚无根据年龄调整用药剂量的推荐。21项双盲、对照、临床安全性和有效性临床试验的合并数据显示,使用本药的5936名患者中,1424名(24%)年龄≥65岁,207名(3.5%)年龄≥75岁。调整肾功能水平(肌酐清除率)后,65岁以上患者与65岁以下患者疗效相似。在年龄≥65岁患者中,因血容量不足和肾功能损害或肾衰竭出现不良反应的患者比例较安慰剂组高。
【肾受损用药】在一项研究包括有中度肾受损患者(eGFR 30至低于60 mL/min/1.73 m2)评价达格列净的安全性和疗效。与安慰剂治疗患者比较,患者有中度肾受损用达格列净治疗血糖控制没有改善[见临床研究]和有更多肾相关不良反应和更多骨折[见用法用量,注意事项,不良反应];因此,在这个人群中禁用达格列净。 根据其作用机制,达格列净预期在有严重肾受损患者(eGFR 低于 30 mL/min/1.73 m2)或肾病终末期ESRD无效[见禁忌证]。
【肝受损用药】建议对有轻度,中度,或严重肝受损患者无剂量调整。但是,在有严重肝受损患者中应个体地评估达格列净使用的获益-风险,因为在这个人群中尚未专门研究达格列净的安全性和疗效[见临床药理]。
【药物过量】本药临床研究中尚无药物过量的报道。如出现过量,联系中毒防治中心。可根据患者口述的临床状态进行支持治疗。尚无本药血液透析的研究。
【药物相互作用】体外试验中,本药及其代谢物并未抑制CYP 1A2、CYP 2C9、CYP 2C19、CYP 2D6、CYP 3A4,也未诱导CYP 1A2、CYP 2B6、CYP 3A4。本药为弱效P-糖蛋白(P-gp)活性转运体底物,其代谢物为有机阴离子转运载体(OAT)3活性底物。本药及其代谢物并未有意义的抑制P-gp OCT2、P-gp OCT1、P-gp OCT3,故本药与P-gp OCT2、P-gp OCT1、P-gp OCT3底物药物合用时,不影响其药物动力学。
其他药物对本药的影响
本药与其他药物合用的药物动力学作用见表8,合用时无需调整本药剂量。
【药理毒理】作用机制
近端肾小管中表达钠-葡萄糖协同转运蛋白 2(SGLT2),负责人类肾小管腔内被过滤葡萄糖再吸收的大部分。达格列净是 SGLT2 的一种抑制剂。通过抑制 SGLT2,达格列净减低已过滤葡萄糖的再吸收和减 低肾葡萄糖阈值,和因此增加尿葡萄糖排泄。 12.2 药效动力学 一般 在健康受试者和在 2 型糖尿病患者中给予达格列净后观察到尿中葡萄糖排泄量的增加(见图 1)。 在2 型糖尿病患者中达格列净剂量 10 mg 每天共 12 周导致在 12 周时每天尿中葡萄糖排泄约 70 克。 在每天达格列净剂量 20 mg观察到接近最大葡萄糖排泄。这个随达格列净尿葡萄糖排泄也导致尿 量增加[见不良反应]。
在健康受试者和 2 型糖尿病受试者(T2DM)中在 24-小时尿葡萄糖量从基线变化相比 达格列净剂量的散点图和拟合曲线(半-Log 图) 心脏电生理 在健康受试者的一项研究每天剂量至达格列净150 mg(推荐最大剂量 15 倍)不伴随临床上有意义的 Q Tc 间期延长。此外,在健康受试者中单剂量达格列净至 500 mg(推荐最大剂量 50 倍)未观察到对 Q Tc 间期临床上有意义影响。
非临床毒理学
癌发生,突变发生,生育能力受损 在 2-年致癌性研究在或小鼠或大鼠中在任何评价剂量 达格列净不诱发肿瘤。在小鼠中口服剂量在雄 性中为 5,15,and 40 mg/kg/day 和在雌性中 2, 10,and 20 mg/kg/day 组成,而大鼠口服剂量雄性和雌 性二者均为 0.5,2,和 10 mg/kg/day。根据 AUC 暴露在小鼠中最高评价剂量为临床剂量 10 mg 每天暴露约 72 倍(雄性)和 105 倍(雌性)。 根据 AUC 暴露在大鼠中, 最高剂量为每天临床剂量 10 mg 暴露的约 131 倍(雄 性)和 186 倍(雌性)。 在 Ames 致突变性试验中 达格列净是阴性和在一系列体外染色体畸变试验在存在 S9 激活和在浓度≥1 00 μ g/mL 中是阳性。对染色体畸变在一系列体内研究大鼠中在暴露多次>临床剂量 2100 倍评价微核或 DN A 修复达格列净是阴性。
在动物研究中没有致癌性或致突变性信号,提示达格列净不代表对人类遗传毒性风险。达格列净在暴露多次为人类最大推荐剂量男性和女性分别≤1708 倍和 998 倍对在处理雄性或雌性大 鼠交配,生育能力,或早期胚胎发育没有影响。
【药代动力学】吸收
空腹状态下,血浆达峰浓度(Cmax)通常在口服达格列净后2小时内达到。在治疗剂量范围内,Cmax 和 AUC 值随达格列净剂量正比例地增加。给予10mg达格列净后,其绝对口服生物利用度是78%。服药同时食用高脂膳食,与空腹状态相比,达格列净Cmax 降低高达50%,Tmax 延长约 1 小时,但AUC不变。上诉变化不被认为有临床上意义。 达格列净可与或不与食物同服。
达格列净蛋白结合率约为 91%。肾功能不全或肝功能受损不会改变蛋白结合。
代谢
达格列净主要经 UGT1A9 介导代谢;CYP-介导代谢是作用较弱的清楚路径。达格列净广泛地代谢,主要形成达格列净3-O-葡萄糖醛酸(非活性代谢产物),是一种无活性代谢物。Dapagliflozin 3 -葡萄糖醛酸占 50 mg[14C]-dapagliflozin 剂量 61%和是人类血浆中占优势的药物相关成分。
消除
达格列净及相关代谢物是主要地通过肾途径消除。50 mg 剂量给药后,总放射性的 75%和 21分别经尿液和粪便排出。不到2%剂量以原型药物经尿液排出,约 15%剂量以原型 药物经粪便排泄。单剂量口服达格列净10 mg 后,达格列净平均血浆末端半衰期(t?)约 12.9 小时。
特殊人群
肾功能不全患者
与肾功能正常的 2 型糖尿病患者相比,轻度,中度,或重度肾功能不全(由eGFR确定)的2型糖尿病患者在稳态时(20 mg 每天 1 次,连服 7 天)达格列净全身暴露量几何平均值分别高出45%, 2. 04倍,和 3.03倍。在伴有肾功能不全的 2 型糖尿病患者中达格列净暴露量未导致24小时尿糖排泄量相应地升高。稳态 24-小时尿葡萄糖排泄在 2 型糖尿病患者和轻度,中度,和严重肾受损与有正常 肾功能 2 型糖尿病患者比较分别为较低 42%,80%,和 90%。不清楚血液透析对达格列净暴露的影响。 [见用法用量,注意事项和临床实验)]。
肝受损
单剂量口服10 mg达格列净后 轻度和中度肝受损受试者(Child-Pugh 类型 A 和 B)的均数 Cmax 和 AUC 相对匹配的对照组健康受试者分别至较高达 12%和 36%。认为这些差异不具有临床意义。对于严重肝受损患者(Child-Pugh 类别 C)当与健康匹配对照比较时,达格列净的均数 Cmax 和 AUC 分别较高至 40%和 67%[参见用法用量]。
年龄,性别,种族,和体重对药代动力学的影响
基于一项群体药代动力学分析,年龄,性别,种族,和体重对达格列净的药代动力学没有临床上有意义的作用,因此,不建议剂量调整。
【贮藏】于20-25℃(15-30℃)保存。
【有效期】36个月
【生产企业】AstraZeneca Pharmaceuticals LP