гҖҗдә§е“ҒеҗҚз§°гҖ‘жҒ©жӣҝеҚЎйҹҰеҲҶж•ЈзүҮ
гҖҗиӢұж–ҮеҗҚгҖ‘Entecavir Dispersible Tablets
гҖҗжұүиҜӯжӢјйҹігҖ‘EnTiKaWeiFenSanPian
гҖҗдё»иҰҒжҲҗд»ҪгҖ‘
жң¬е“Ғдё»иҰҒжҲҗеҲҶдёәпјҡжҒ©жӣҝеҚЎйҹҰгҖӮ
еҢ–еӯҰеҗҚз§°пјҡ2-ж°Ёеҹә-9-[(1S,3R,4S)-4-зҫҹеҹә-3-зҫҹз”Іеҹә-2-дәҡз”ІеҹәзҺҜжҲҠеҹә]-1пјҢ9-дәҢж°ў-6H-еҳҢе‘Ө-6-й…®дёҖж°ҙеҗҲзү©гҖӮ
гҖҗжҖ§зҠ¶гҖ‘жң¬е“ҒдёәзҷҪиүІжҲ–зұ»зҷҪиүІзүҮгҖӮ
гҖҗйҖӮеә”з—ҮгҖ‘жң¬е“ҒйҖӮз”ЁдәҺз—…жҜ’еӨҚеҲ¶жҙ»и·ғпјҢиЎҖжё…иҪ¬ж°Ёй…¶ALTжҢҒз»ӯеҚҮй«ҳжҲ–иӮқи„Ҹз»„з»ҮеӯҰжҳҫзӨәжңүжҙ»еҠЁжҖ§з—…еҸҳзҡ„ж…ўжҖ§жҲҗдәәд№ҷеһӢиӮқзӮҺзҡ„жІ»з–—гҖӮ
гҖҗз”Ёжі•з”ЁйҮҸгҖ‘
жӮЈиҖ…еә”еңЁжңүз»ҸйӘҢзҡ„еҢ»з”ҹжҢҮеҜјдёӢжңҚз”Ёжң¬е“ҒгҖӮжҺЁиҚҗеүӮйҮҸпјҡжҲҗдәәе’Ң16еІҒеҸҠд»ҘдёҠзҡ„йқ’е°‘е№ҙеҸЈжңҚжң¬е“ҒпјҢжҜҸеӨ©дёҖж¬ЎпјҢжҜҸж¬Ў0.5mgпјҲдёҖзүҮпјүгҖӮжӢүзұіеӨ«е®ҡжІ»з–—ж—¶еҸ‘з”ҹз—…жҜ’иЎҖз—ҮжҲ–еҮәзҺ°жӢүзұіеӨ«е®ҡиҖҗиҚҜзӘҒеҸҳзҡ„жӮЈиҖ…дёәжҜҸеӨ©дёҖж¬ЎпјҢжҜҸж¬Ў1mg( дёӨзүҮ)гҖӮжң¬е“Ғеә”з©әи…№жңҚз”Ё(йӨҗеүҚжҲ–йӨҗеҗҺиҮіе°‘2е°Ҹж—¶)гҖӮ
иӮҫеҠҹиғҪдёҚе…ЁпјҡеңЁиӮҫеҠҹиғҪдёҚе…Ёзҡ„жӮЈиҖ…дёӯпјҢжҒ©жӣҝеҚЎйҹҰзҡ„иЎЁи§ӮеҸЈжңҚжё…йҷӨзҺҮйҡҸиӮҢй…җжё…йҷӨзҺҮзҡ„йҷҚдҪҺиҖҢйҷҚдҪҺ(еҸӮи§ҒиҚҜд»ЈеҠЁеҠӣеӯҰпјҢзү№ж®ҠдәәзҫӨ)гҖӮиӮҢй…җжё…йҷӨзҺҮ<50mL/еҲҶй’ҹзҡ„жӮЈиҖ…(еҢ…жӢ¬жҺҘеҸ—иЎҖж¶ІйҖҸжһҗжҲ–CAPDжІ»з–—зҡ„жӮЈиҖ…)еә”и°ғж•ҙз”ЁиҚҜеүӮйҮҸгҖӮи§ҒиЎЁ1гҖӮ
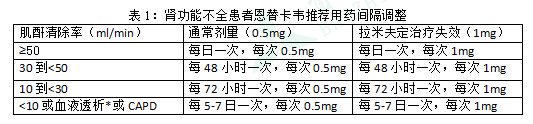
*жҺҘеҸ—иЎҖж¶ІйҖҸжһҗзҡ„жӮЈиҖ…пјҢиҜ·еңЁиЎҖж¶ІйҖҸжһҗеҗҺз”ЁиҚҜгҖӮ
иӮқеҠҹиғҪдёҚе…ЁпјҡиӮқеҠҹиғҪдёҚе…ЁжӮЈиҖ…ж— йңҖи°ғж•ҙз”ЁиҚҜеүӮйҮҸгҖӮ
жІ»з–—жңҹпјҡе…ідәҺжң¬е“Ғзҡ„жңҖдҪіжІ»з–—ж—¶й—ҙпјҢд»ҘеҸҠдёҺй•ҝжңҹзҡ„жІ»з–—з»“жһңзҡ„е…ізі»гҖӮеҰӮиӮқзЎ¬еҢ–гҖҒиӮқзҷҢзӯүпјҢзӣ®еүҚе°ҡжңӘжҳҺдәҶгҖӮ
гҖҗдёҚиүҜеҸҚеә”гҖ‘
еҜ№дёҚиүҜеҸҚеә”зҡ„иҜ„д»·еҹәдәҺ4йЎ№е…Ёзҗғзҡ„дёҙеәҠиҜ•йӘҢпјҡAI463014пјҢAI463022пјҢAI463026пјҢAI463027д»ҘеҸҠ3йЎ№еңЁдёӯеӣҪиҝӣиЎҢзҡ„дёҙеәҠиҜ•йӘҢ(AI463012пјҢAI463023пјҢAI463056)гҖӮеңЁиҝҷ7йЎ№з ”з©¶дёӯпјҢе…ұжңү2596дҪҚж…ўжҖ§д№ҷиӮқжӮЈиҖ…е…ҘйҖүгҖӮеңЁдёҺжӢүзұіеӨ«е®ҡеҜ№з…§зҡ„з ”з©¶дёӯпјҢжҒ©жӣҝеҚЎйҹҰдёҺжӢүзұіеӨ«е®ҡзҡ„дёҚиүҜдәӢ件е’Ңе®һйӘҢе®ӨжЈҖжҹҘејӮеёёжғ…еҶөзӣёдјјгҖӮ
еңЁеӣҪеӨ–иҝӣиЎҢзҡ„з ”з©¶дёӯпјҢжң¬е“ҒжңҖеёёи§Ғзҡ„дёҚиүҜдәӢ件жңүпјҡеӨҙз—ӣгҖҒз–ІеҠігҖҒзң©жҷ•гҖҒжҒ¶еҝғгҖӮжӢүзұіеӨ«е®ҡжІ»з–—зҡ„жӮЈиҖ…жҷ®йҒҚеҮәзҺ°зҡ„дёҚиүҜдәӢ件жңүпјҡеӨҙз—ӣгҖҒз–ІеҠігҖҒзң©жҷ•гҖӮеңЁиҝҷ4йЎ№з ”з©¶дёӯпјҢеҲҶеҲ«жңү1%зҡ„жҒ©жӣҝеҚЎйҹҰжІ»з–—зҡ„жӮЈиҖ…е’Ң4%жӢүзұіеӨ«е®ҡжІ»з–—зҡ„жӮЈиҖ…з”ұдәҺдёҚиүҜдәӢ件е’Ңе®һйӘҢе®ӨжЈҖжөӢжҢҮж ҮејӮеёёиҖҢйҖҖеҮәз ”з©¶гҖӮ
еӣҪеӨ–дёҙеәҠдёҚиүҜдәӢ件
иЎЁ2жҜ”иҫғдәҶеңЁ4йЎ№дёҙеәҠз ”з©¶дёӯжҒ©жӣҝеҚЎйҹҰе’ҢжӢүзұіеӨ«е®ҡзҡ„дёҚеҗҢгҖӮе…¶дёӯйҖүжӢ©дәҶдёӯеҲ°йҮҚеәҰдёҚиүҜдәӢ件е’ҢжІ»з–—иҝҮзЁӢдёӯеҸ‘з”ҹзҡ„иҮіе°‘жңүеҸҜиғҪдёҺжІ»з–—зӣёе…ізҡ„дёҙеәҠдёҚиүҜдәӢ件дҪңдёәжҜ”иҫғзҡ„жҢҮж ҮгҖӮ

a еҢ…жӢ¬еҸҜиғҪгҖҒеҫҲеҸҜиғҪгҖҒзӣёе…іжҲ–дёҚжё…жҘҡжҳҜеҗҰдёҺжІ»з–—ж–№жі•зӣёе…ізҡ„дёҚиүҜдәӢ件гҖӮ
b AI463022е’ҢAI463027з ”з©¶гҖӮ
c еҢ…жӢ¬AI463026е’ҢAI463014пјҢAI463014з ”з©¶жҳҜдёҖдёӘеӨҡеӣҪ家зҡ„гҖҒйҡҸжңәеҸҢзӣІзҡ„в…Ўжңҹз ”з©¶пјҢиҜҘз ”з©¶жҳҜеңЁдҪҝз”ЁжӢүзұіеӨ«е®ҡжІ»з–—дёӯеӨҚеҸ‘з—…жҜ’иЎҖз—Үзҡ„жӮЈиҖ…дёӯиҝӣиЎҢгҖӮиҝҷдәӣжӮЈиҖ…жҲ–ж”№дёәжҜҸж—ҘдёҖж¬ЎжңҚз”Ёдёүз§ҚдёҚеҗҢеүӮйҮҸзҡ„жҒ©жӣҝеҚЎйҹҰпјҲ0.1пјҢ0.5е’Ң1.0mgпјүпјҢжҲ–继з»ӯжҜҸж—ҘдёҖж¬ЎжңҚз”Ё100mgжӢүзұіеӨ«е®ҡпјҢжҢҒз»ӯ52е‘ЁгҖӮ
еӣҪеӨ–е®һйӘҢе®ӨжЈҖжөӢжҢҮж ҮејӮеёё
иЎЁ3 еҲ—еҮәеӣӣйЎ№дёҙеәҠиҜ•йӘҢдёӯдҪҝз”ЁжҒ©жӣҝеҚЎйҹҰе’ҢжӢүзұіеӨ«е®ҡжІ»з–—еҗҺпјҢе®һйӘҢе®ӨжЈҖжҹҘејӮеёёзҡ„еҸ‘з”ҹйў‘зҺҮгҖӮ
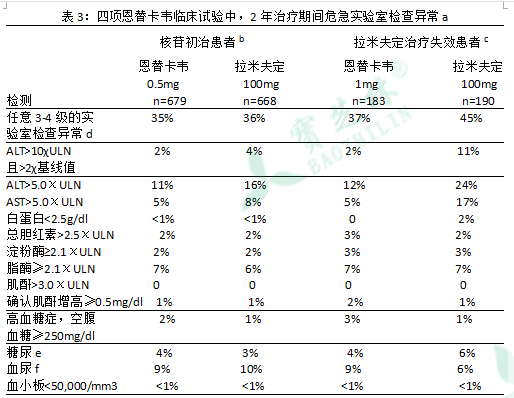
a жІ»з–—жңҹй—ҙпјҢйҷӨзҷҪиӣӢзҷҪпјҲ<2.5 g/dlпјүпјҢиӮҢй…җеўһй«ҳ≥0.5 mg/dlпјҢALT>10 χULNе’Ңпјһ2еҖҚеҹәзәҝж°ҙе№ід»ҘеӨ–жүҖжңүжҢҮж ҮиҫғеҹәзәҝеҖјеҸҳе·®иҫҫ3зә§жҲ–4зә§гҖӮ
b AI463022е’ҢAI463027з ”з©¶гҖӮ
c еҢ…жӢ¬AI463026е’ҢAI463014пјҢAI463014з ”з©¶жҳҜдёҖдёӘеӨҡеӣҪ家зҡ„гҖҒйҡҸжңәеҸҢзӣІзҡ„в…Ўжңҹз ”з©¶пјҢиҜҘз ”з©¶еңЁдҪҝз”ЁжӢүзұіеӨ«е®ҡжІ»з–—дёӯеӨҚеҸ‘з—…жҜ’иЎҖз—Үзҡ„жӮЈиҖ…дёӯиҝӣиЎҢгҖӮиҝҷдәӣжӮЈиҖ…жҲ–ж”№дёәжҜҸж—ҘдёҖж¬ЎжңҚз”Ёдёүз§ҚдёҚеҗҢеүӮйҮҸзҡ„жҒ©жӣҝеҚЎйҹҰпјҲ0.1пјҢ0.5е’Ң1.0 mgпјүпјҢжҲ–继з»ӯжҜҸж—ҘдёҖж¬ЎжңҚз”Ё100 mgжӢүзұіеӨ«е®ҡпјҢжҢҒз»ӯ52е‘ЁгҖӮ
d еҢ…жӢ¬иЎҖ常规гҖҒ常规з”ҹеҢ–гҖҒиӮҫеҠҹиғҪе’ҢиӮқеҠҹиғҪжЈҖжҹҘгҖҒиғ°й…¶е’Ңе°ҝ常规гҖӮ
e 3зә§=3 +еӨ§йҮҸгҖҒ≥500mg/dLпјӣ4зә§=4+ пјҢжҳҫзқҖгҖҒдёҘйҮҚгҖӮ
f 3зә§=3 +еӨ§йҮҸпјӣ4зә§=≥4+ пјҢжҳҫзқҖгҖҒдёҘйҮҚгҖҒеӨҡйҮҸгҖӮ
еңЁиҝҷдәӣз ”з©¶дёӯпјҢдҪҝз”ЁжҒ©жӣҝеҚЎйҹҰзҡ„жӮЈиҖ…еңЁжІ»з–—иҝҮзЁӢдёӯеҸ‘з”ҹALTеўһй«ҳиҫҫ10еҖҚзҡ„жӯЈеёёеҖјдёҠйҷҗе’ҢеҹәзәҝеҖјзҡ„2еҖҚж—¶пјҢйҖҡ常继з»ӯз”ЁиҚҜдёҖж®өж—¶й—ҙпјҢALTеҸҜжҒўеӨҚжӯЈеёёпјӣеңЁжӯӨд№ӢеүҚжҲ–еҗҢж—¶дјҙйҡҸжңүз—…жҜ’иҪҪйҮҸ2дёӘеҜ№ж•°еҖјзҡ„дёӢйҷҚгҖӮж•…еңЁз”ЁиҚҜжңҹй—ҙпјҢйңҖе®ҡжңҹжЈҖжөӢиӮқеҠҹиғҪгҖӮ
еҒңжӯўжІ»з–—еҗҺзҡ„иӮқзӮҺеҠ еү§пјҲи§Ғ[иӯҰе‘Ҡ]пјү
иӮқзӮҺжҖҘжҖ§еҠ еү§жҲ–ALTеӨҚзҮғзҡ„е®ҡд№үдёәпјҡALTеӨ§дәҺ10еҖҚзҡ„жӯЈеёёеҖјдёҠйҷҗе’ҢеӨ§дәҺ2еҖҚжӮЈиҖ…зҡ„еҸӮиҖғж°ҙе№іпјҲеҹәзәҝеҖјжҲ–еҒңиҚҜж—¶жңҖеҗҺдёҖж¬ЎжЈҖжөӢеҖјй—ҙзҡ„жңҖе°ҸеҖјпјүгҖӮжүҖжңүеҒңжӯўжІ»з–—пјҲж— и®әдҪ•з§ҚеҺҹеӣ пјүзҡ„жӮЈиҖ…дёӯпјҢеҮәзҺ°дәҶALTеӨҚзҮғзҡ„жӮЈиҖ…дҫӢж•°еқҮи®°еҪ•еңЁиЎЁ4дёӯгҖӮиҝҷдәӣз ”з©¶дёӯпјҢеҰӮжһңеңЁз¬¬52е‘ЁжҲ–д№ӢеҗҺиҫҫеҲ°ж–№жЎҲжүҖ规е®ҡзҡ„жІ»з–—еә”зӯ”еҗҺпјҢеҸҜе…Ғи®ёдёҖдәҡз»„жӮЈиҖ…еҒңиҚҜгҖӮеҰӮжһңжңӘиҫҫеҲ°жІ»з–—еә”зӯ”иҖҢеҒңз”ЁжҒ©жӣҝеҚЎйҹҰпјҢеҲҷеҒңиҚҜеҗҺеҸ‘з”ҹALTеӨҚзҮғзҡ„жҰӮзҺҮеҸҜиғҪжӣҙй«ҳгҖӮ
иЎЁ4пјҡеңЁAI463022гҖҒAI463027е’ҢAI463026з ”з©¶дёӯпјҢж ёиӢ·зұ»иҚҜзү©еҲқжІ»жӮЈиҖ…еңЁеҒңиҚҜеҗҺйҡҸи®ҝжңҹеҸ‘з”ҹзҡ„иӮқзӮҺжҒ¶еҢ–

a еҸӮиҖғеҖјжҳҜжҢҮеҹәзәҝжҲ–еҒңиҚҜж—¶жңҖеҗҺдёҖж¬ЎжЈҖжөӢеҖјдёӯзҡ„жңҖе°ҸеҖјгҖӮеҒңиҚҜеҗҺжҒ¶еҢ–зҡ„дёӯдҪҚж—¶й—ҙеҜ№дәҺжҒ©жӣҝеҚЎйҹҰжІ»з–—зҡ„жӮЈиҖ…дёә23е‘ЁпјҢиҖҢеҜ№дәҺжӢүзұіеӨ«е®ҡжІ»з–—зҡ„жӮЈиҖ…дёә10е‘ЁгҖӮ
AI463038еҸҢзӣІз ”究дёӯи§ӮеҜҹеҲ°пјҢHBVеҗҲ并ж„ҹжҹ“HIVзҡ„жӮЈиҖ…жҺҘеҸ—жҒ©жӣҝеҚЎйҹҰ1mgпјҲN=51пјүжҲ–е®үж…°еүӮпјҲN=17пјүжІ»з–—24е‘ЁпјҢдёӨз»„зҡ„е®үе…ЁжҖ§зӣёдјјпјҢ并且дёҺжңӘеҗҲ并ж„ҹжҹ“HIVжӮЈиҖ…дёӯи§ӮеҜҹеҲ°зҡ„е®үе…ЁжҖ§зӣёдјјпјҲи§Ғ[иӯҰе‘Ҡ]3пјҡеҗҲ并ж„ҹжҹ“HIVпјүгҖӮ
еңЁдёӯеӣҪиҝӣиЎҢзҡ„дёҙеәҠиҜ•йӘҢдёӯпјҢжңҖеёёи§Ғзҡ„дёҚиүҜдәӢ件жңүпјҡALTеҚҮй«ҳгҖҒз–ІеҠігҖҒзң©жҷ•гҖҒжҒ¶еҝғгҖҒи…№з—ӣгҖҒи…№йғЁдёҚйҖӮгҖҒдёҠи…№з—ӣгҖҒиӮқеҢәдёҚйҖӮгҖҒиӮҢз—ӣгҖҒеӨұзң е’ҢйЈҺз–№гҖӮиҝҷдәӣдёҚиүҜдәӢ件еӨҡдёәиҪ»еҲ°дёӯеәҰгҖӮеңЁдёҺжӢүзұіеӨ«е®ҡеҜ№з…§зҡ„иҜ•йӘҢдёӯпјҢжң¬е“ҒдёҚиүҜдәӢ件зҡ„еҸ‘з”ҹзҺҮдёҺжӢүзұіеӨ«е®ҡзӣёеҪ“гҖӮ
гҖҗзҰҒеҝҢгҖ‘еҜ№жҒ©жӣҝеҚЎйҹҰжҲ–еҲ¶еүӮдёӯд»»дҪ•жҲҗд»ҪиҝҮж•ҸиҖ…зҰҒз”ЁгҖӮ
гҖҗиӯҰе‘ҠгҖ‘
1. еҒңжӯўжІ»з–—еҗҺзҡ„иӮқзӮҺеҠ еү§
еҪ“ж…ўжҖ§д№ҷиӮқжӮЈиҖ…еҒңжӯўжҠ—д№ҷиӮқжІ»з–—еҗҺпјҢеҢ…жӢ¬жҒ©жӣҝеҚЎйҹҰеңЁеҶ…пјҢжңүжҠҘйҒ“еҮәзҺ°д№ҷиӮқдёҘйҮҚжҖҘжҖ§еҠ еү§гҖӮеҜ№йӮЈдәӣеҒңжӯўжҠ—д№ҷиӮқжІ»з–—жӮЈиҖ…зҡ„иӮқеҠҹиғҪжғ…еҶөпјҢеә”д»ҺдёҙеәҠе’Ңе®һйӘҢе®ӨжЈҖжҹҘзӯүж–№йқўдёҘеҜҶзӣ‘жөӢ并且иҮіе°‘йҡҸи®ҝж•°жңҲгҖӮеҰӮеҝ…иҰҒпјҢеҸҜйҮҚж–°жҒўеӨҚжҠ—д№ҷиӮқз—…жҜ’зҡ„жІ»з–—гҖӮ
2. ж ёиӢ·зұ»иҚҜзү©еңЁеҚ•зӢ¬жҲ–дёҺе…¶д»–жҠ—йҖҶиҪ¬еҪ•з—…жҜ’иҚҜзү©иҒ”еҗҲдҪҝз”Ёж—¶пјҢе·Із»Ҹжңүд№ій…ёжҖ§й…ёдёӯжҜ’е’ҢйҮҚеәҰзҡ„и„ӮиӮӘжҖ§иӮқиӮҝеӨ§пјҢеҢ…жӢ¬жӯ»дәЎз—…дҫӢзҡ„жҠҘйҒ“гҖӮ
3.еҗҲ并ж„ҹжҹ“HIV
е°ҡжңӘеңЁHBVеҗҲ并HIVж„ҹжҹ“并且жңӘжҺҘеҸ—жңүж•Ҳзҡ„HIVжІ»з–—зҡ„жӮЈиҖ…дёӯиҜ„д»·жҒ©жӣҝеҚЎйҹҰгҖӮжңүйҷҗзҡ„дёҙеәҠз»ҸйӘҢжҸҗзӨәпјҢеҰӮжһңжҒ©жӣҝеҚЎйҹҰз”ЁдәҺж…ўжҖ§д№ҷиӮқеҗҲ并HIVж„ҹжҹ“дё”жңӘз»ҸжҠ—HIVжІ»з–—зҡ„жӮЈиҖ…пјҢжңүеҸҜиғҪеҮәзҺ°еҜ№HIVж ёиӢ·йҖҶиҪ¬еҪ•й…¶жҠ‘еҲ¶еүӮзҡ„иҖҗиҚҜпјҲи§Ғ[иҚҜзҗҶжҜ’зҗҶ]еҫ®з”ҹзү©еӯҰ жҠ—з—…жҜ’жҙ»жҖ§пјҢжҠ—HIVз—…жҜ’жҙ»жҖ§пјүгҖӮеӣ жӯӨпјҢдёҚе»әи®®HBVеҗҲ并ж„ҹжҹ“HIV并жңӘжҺҘеҸ—й«ҳж•ҲжҠ—йҖҶиҪ¬еҪ•з—…жҜ’жІ»з–—пјҲHAARTпјүзҡ„жӮЈиҖ…дҪҝз”ЁжҒ©жӣҝеҚЎйҹҰгҖӮејҖе§ӢжҒ©жӣҝеҚЎйҹҰжІ»з–—еүҚпјҢеә”иҜҘжЈҖжөӢжүҖжңүжӮЈиҖ…зҡ„HIVжҠ—дҪ“гҖӮе°ҡжңӘиҝӣиЎҢжҒ©жӣҝеҚЎйҹҰжІ»з–—HIVж„ҹжҹ“зҡ„з ”з©¶пјҢеӣ жӯӨдёҚжҺЁиҚҗиҜҘз”ЁйҖ”гҖӮ
гҖҗжіЁж„ҸдәӢйЎ№гҖ‘
иӮҫеҠҹиғҪдёҚе…Ёзҡ„жӮЈиҖ…
иӮҢй…җжё…йҷӨзҺҮ<50ml/minпјҢеҢ…жӢ¬иЎҖйҖҸжһҗжҲ–CAPDзҡ„жӮЈиҖ…пјҢе»әи®®и°ғж•ҙжҒ©жӣҝеҚЎйҹҰзҡ„з»ҷиҚҜеүӮйҮҸпјҲи§ҒгҖҗз”Ёжі•з”ЁйҮҸгҖ‘пјүгҖӮ
иӮқ移жӨҚеҸ—дҪ“жӮЈиҖ…
жҒ©жӣҝеҚЎйҹҰжІ»з–—иӮқ移жӨҚеҸ—дҪ“зҡ„е®үе…ЁжҖ§е’Ңжңүж•ҲжҖ§е°ҡдёҚжё…жҘҡгҖӮеҰӮжһңи®ӨдёәиӮқ移жӨҚеҸ—дҪ“йңҖиҰҒжҺҘеҸ—жҒ©жӣҝеҚЎйҹҰжІ»з–—пјҢе…¶жӣҫз»ҸжҲ–жӯЈеңЁжҺҘеҸ—еҸҜиғҪеҪұе“ҚиӮҫеҠҹиғҪзҡ„е…Қз–«жҠ‘еҲ¶пјҢеҰӮпјҡзҺҜеӯўиҸҢзҙ жҲ–д»–е…ӢиҺ«еҸёзҡ„жІ»з–—пјҢеә”еңЁжҒ©жӣҝеҚЎйҹҰз»ҷиҚҜеүҚеҸҠз»ҷиҚҜиҝҮзЁӢдёӯдёҘеҜҶзӣ‘жөӢиӮҫеҠҹиғҪгҖӮпјҲи§ҒгҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘)гҖӮ
жӮЈиҖ…йЎ»зҹҘ
жӮЈиҖ…еә”еңЁеҢ»з”ҹзҡ„жҢҮеҜјдёӢжңҚз”ЁжҒ©жӣҝеҚЎйҹҰпјҢ并е‘ҠзҹҘеҢ»з”ҹд»»дҪ•ж–°еҮәзҺ°зҡ„з—ҮзҠ¶еҸҠеҗҲ并用иҚҜжғ…еҶөгҖӮеә”е‘ҠзҹҘжӮЈиҖ…еҰӮжһңеҒңиҚҜжңүж—¶дјҡеҮәзҺ°иӮқи„Ҹз—…жғ…еҠ йҮҚпјҢжүҖд»Ҙеә”еңЁеҢ»з”ҹзҡ„жҢҮеҜјдёӢж”№еҸҳжІ»з–—ж–№жі•гҖӮ
жӮЈиҖ…еңЁејҖе§ӢжҒ©жӣҝеҚЎйҹҰжІ»з–—еүҚпјҢйңҖиҰҒиҝӣиЎҢHIVжҠ—дҪ“зҡ„жЈҖжөӢгҖӮеә”е‘ҠзҹҘжӮЈиҖ…еҰӮжһңж„ҹжҹ“дәҶHIVиҖҢжңӘжҺҘеҸ—жңүж•Ҳзҡ„HIVиҚҜзү©жІ»з–—пјҢжҒ©жӣҝеҚЎйҹҰеҸҜиғҪдјҡеўһеҠ еҜ№HIVиҚҜзү©жІ»з–—иҖҗиҚҜзҡ„жңәдјҡпјҲи§ҒгҖҗиӯҰе‘ҠгҖ‘3.еҗҲ并ж„ҹжҹ“HIVпјүгҖӮ
дҪҝз”ЁжҒ©жӣҝеҚЎйҹҰ治疗并дёҚиғҪйҷҚдҪҺз»ҸжҖ§жҺҘи§ҰжҲ–жұЎжҹ“иЎҖжәҗдј ж’ӯHBVзҡ„еҚұйҷ©жҖ§гҖӮеӣ жӯӨпјҢйңҖиҰҒйҮҮеҸ–йҖӮеҪ“зҡ„йҳІжҠӨжҺӘж–ҪгҖӮ
гҖҗеӯ•еҰҮеҸҠеҰҠеЁ з”ЁиҚҜгҖ‘
жҒ©жӣҝеҚЎйҹҰеҜ№еҰҠеЁ еҰҮеҘіеҪұе“Қзҡ„з ”з©¶е°ҡдёҚе……еҲҶгҖӮеҸӘжңүеҪ“еҜ№иғҺе„ҝжҪңеңЁзҡ„йЈҺйҷ©-еҲ©зӣҠдҪңеҮәе……еҲҶзҡ„жқғиЎЎеҗҺпјҢж–№еҸҜдҪҝз”Ёжң¬е“ҒгҖӮ
зӣ®еүҚе°ҡж— иө„ж–ҷжҸҗзӨәжң¬е“ҒиғҪеҪұе“ҚHBVзҡ„жҜҚе©ҙдј ж’ӯпјҢеӣ жӯӨпјҢеә”йҮҮеҸ–йҖӮеҪ“зҡ„е№Ійў„жҺӘж–Ҫд»ҘйҳІжӯўж–°з”ҹе„ҝж„ҹжҹ“HBVгҖӮ
жҒ©жӣҝеҚЎйҹҰеҸҜд»ҺеӨ§йј д№іжұҒеҲҶжіҢгҖӮдҪҶдәәд№ідёӯжҳҜеҗҰжңүеҲҶжіҢд»ҚдёҚжё…жҘҡпјҢжүҖд»ҘдёҚжҺЁиҚҗжңҚз”Ёжң¬е“Ғзҡ„жҜҚдәІе“әд№ігҖӮ
гҖҗе„ҝз«Ҙз”ЁиҚҜгҖ‘16еІҒд»ҘдёӢе„ҝз«ҘжӮЈиҖ…дҪҝз”Ёжң¬е“Ғзҡ„е®үе…ЁжҖ§е’Ңжңүж•ҲжҖ§ж•°жҚ®е°ҡжңӘе»әз«ӢгҖӮ
гҖҗиҖҒе№ҙз”ЁиҚҜгҖ‘з”ұдәҺжІЎжңүи¶іеӨҹзҡ„65еІҒеҸҠд»ҘдёҠзҡ„иҖҒе№ҙжӮЈиҖ…еҸӮеҠ жң¬е“Ғзҡ„дёҙеәҠз ”з©¶пјҢе°ҡдёҚжё…жҘҡиҖҒе№ҙжӮЈиҖ…дёҺе№ҙиҪ»жӮЈиҖ…еҜ№жң¬е“Ғзҡ„еҸҚеә”жңүдҪ•дёҚеҗҢгҖӮе…¶д»–зҡ„дёҙеәҠиҜ•йӘҢжҠҘе‘Ҡд№ҹжңӘеҸ‘зҺ°иҖҒе№ҙжӮЈиҖ…дёҺе№ҙиҪ»жӮЈиҖ…д№Ӣй—ҙзҡ„дёҚеҗҢгҖӮжҒ©жӣҝеҚЎйҹҰдё»иҰҒз”ұиӮҫи„ҸжҺ’жі„пјҢеңЁиӮҫеҠҹиғҪжҚҹдјӨзҡ„жӮЈиҖ…дёӯпјҢеҸҜиғҪеҸ‘з”ҹжҜ’жҖ§еҸҚеә”зҡ„еҚұйҷ©жҖ§жӣҙй«ҳгҖӮеӣ дёәиҖҒе№ҙжӮЈиҖ…еӨҡж•°иӮҫеҠҹиғҪжңүжүҖдёӢйҷҚпјҢеӣ жӯӨеә”жіЁж„ҸиҚҜзү©еүӮйҮҸзҡ„йҖүжӢ©пјҢ并且зӣ‘жөӢиӮҫеҠҹиғҪгҖӮ
гҖҗиҚҜзү©зӣёдә’дҪңз”ЁгҖ‘
дҪ“еҶ…е’ҢдҪ“еӨ–иҜ•йӘҢиҜ„д»·дәҶжҒ©жӣҝеҚЎйҹҰзҡ„д»Ји°ўжғ…еҶөгҖӮжҒ©жӣҝеҚЎйҹҰдёҚжҳҜз»ҶиғһиүІзҙ P450пјҲCYP450пјүй…¶зі»з»ҹзҡ„еә•зү©гҖҒжҠ‘еҲ¶еүӮжҲ–иҜұеҜјеүӮгҖӮеңЁжө“еәҰиҫҫеҲ°дәәдҪ“еҶ…жө“еәҰзәҰ10000еҖҚж—¶пјҢжҒ©жӣҝеҚЎйҹҰдёҚжҠ‘еҲ¶д»»дҪ•дё»иҰҒзҡ„дәәCYP450й…¶пјҡ1A2гҖҒ2C9гҖҒ2C19гҖҒ2D6гҖҒ3A4гҖҒ2B6е’Ң2E1гҖӮеңЁжө“еәҰиҫҫеҲ°дәәдҪ“еҶ…жө“еәҰзәҰ340еҖҚж—¶пјҢжҒ©жӣҝеҚЎйҹҰдёҚиҜұеҜјдәәCYP450й…¶пјҡ1A2гҖҒ2C9гҖҒ2C19гҖҒ3A4гҖҒ3A5е’Ң2B6гҖӮеҗҢж—¶жңҚз”ЁйҖҡиҝҮжҠ‘еҲ¶жҲ–иҜұеҜјCYP450зі»з»ҹиҖҢд»Ји°ўзҡ„иҚҜзү©еҜ№жҒ©жӣҝеҚЎйҹҰзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰжІЎжңүеҪұе“ҚгҖӮиҖҢдё”пјҢеҗҢж—¶жңҚз”ЁжҒ©жӣҝеҚЎйҹҰеҜ№е·ІзҹҘзҡ„CYPеә•зү©зҡ„иҚҜд»ЈеҠЁеҠӣеӯҰд№ҹжІЎжңүеҪұе“ҚгҖӮ
з ”з©¶жҒ©жӣҝеҚЎйҹҰдёҺжӢүзұіеӨ«е®ҡпјҢйҳҝеҫ·зҰҸйҹҰе’ҢжӣҝиҜәзҰҸйҹҰзҡ„зӣёдә’дҪңз”Ёж—¶пјҢеҸ‘зҺ°жҒ©жӣҝеҚЎйҹҰе’ҢдёҺе…¶зӣёдә’дҪңз”ЁиҚҜзү©зҡ„зЁіжҖҒиҚҜд»ЈеҠЁеҠӣеӯҰеқҮжІЎжңүж”№еҸҳгҖӮ
з”ұдәҺжҒ©жӣҝеҚЎйҹҰдё»иҰҒйҖҡиҝҮиӮҫи„Ҹжё…йҷӨпјҢжңҚз”ЁйҷҚдҪҺиӮҫеҠҹиғҪжҲ–з«һдәүжҖ§йҖҡиҝҮдё»еҠЁиӮҫе°ҸзҗғеҲҶжіҢзҡ„иҚҜзү©зҡ„еҗҢж—¶пјҢжңҚз”ЁжҒ©жӣҝеҚЎйҹҰеҸҜиғҪеўһеҠ иҝҷдёӨдёӘиҚҜзү©зҡ„иЎҖиҚҜжө“еәҰгҖӮеҗҢж—¶жңҚз”ЁжҒ©жӣҝеҚЎйҹҰдёҺжӢүзұіеӨ«е®ҡгҖҒйҳҝеҫ·зҰҸйҹҰгҖҒжӣҝиҜәзҰҸйҹҰдёҚдјҡеј•иө·жҳҺжҳҫзҡ„иҚҜзү©зӣёдә’дҪңз”ЁгҖӮеҗҢж—¶жңҚз”ЁжҒ©жӣҝеҚЎйҹҰдёҺе…¶д»–йҖҡиҝҮиӮҫи„Ҹжё…йҷӨжҲ–е·ІзҹҘеҪұе“ҚиӮҫеҠҹиғҪзҡ„иҚҜзү©зҡ„зӣёдә’дҪңз”Ёе°ҡжңӘз ”з©¶гҖӮжӮЈиҖ…еңЁеҗҢж—¶жңҚз”ЁжҒ©жӣҝеҚЎйҹҰдёҺжӯӨзұ»иҚҜзү©ж—¶иҰҒеҜҶеҲҮзӣ‘жөӢдёҚиүҜеҸҚеә”зҡ„еҸ‘з”ҹгҖӮ
гҖҗиҚҜзү©иҝҮйҮҸгҖ‘зӣ®еүҚе°ҡж— дҪҝз”Ёжң¬е“ҒиҝҮйҮҸзҡ„зӣёе…іжҠҘйҒ“гҖӮеңЁеҒҘеә·дәәзҫӨдёӯеҚ•ж¬Ўз»ҷиҚҜиҫҫ40mgжҲ–иҝһз»ӯ14еӨ©еӨҡж¬Ўз»ҷиҚҜ20mg/еӨ©еҗҺпјҢжңӘи§ӮеҜҹеҲ°дёҚиүҜдәӢ件еҸ‘з”ҹзҡ„еўһеӨҡгҖӮеҰӮжһңеҸ‘з”ҹиҚҜзү©иҝҮйҮҸпјҢйЎ»зӣ‘жөӢжӮЈиҖ…зҡ„жҜ’жҖ§жҢҮж ҮпјҢеҝ…иҰҒж—¶иҝӣиЎҢж ҮеҮҶж”ҜжҢҒз–—жі•гҖӮ
еҚ•ж¬Ўз»ҷиҚҜ1mgжҒ©жӣҝеҚЎйҹҰеҗҺпјҢ4дёӘе°Ҹж—¶зҡ„иЎҖж¶ІйҖҸжһҗеҸҜжё…йҷӨзәҰ13%зҡ„жҒ©жӣҝеҚЎйҹҰгҖӮ
гҖҗиҚҜзҗҶжҜ’зҗҶгҖ‘
пјҲдёҖпјүиҚҜзҗҶдҪңз”Ё
1.еҫ®з”ҹзү©еӯҰ
2.дҪңз”ЁжңәеҲ¶
жң¬е“ҒдёәйёҹеҳҢе‘Өж ёиӢ·зұ»дјјзү©пјҢеҜ№д№ҷиӮқз—…жҜ’пјҲHBVпјүеӨҡиҒҡй…¶е…·жңүжҠ‘еҲ¶дҪңз”ЁгҖӮе®ғиғҪеӨҹйҖҡиҝҮзЈ·й…ёеҢ–жҲҗдёәе…·жңүжҙ»жҖ§зҡ„дёүзЈ·й…ёзӣҗпјҢдёүзЈ·й…ёзӣҗеңЁз»ҶиғһеҶ…зҡ„еҚҠиЎ°жңҹдёә15е°Ҹж—¶гҖӮйҖҡиҝҮдёҺHBVеӨҡиҒҡй…¶зҡ„еӨ©з„¶еә•зү©дёүзЈ·й…ёи„ұж°§йёҹеҳҢе‘Өж ёиӢ·з«һдәүпјҢжҒ©жӣҝеҚЎйҹҰдёүзЈ·й…ёзӣҗиғҪжҠ‘еҲ¶з—…жҜ’еӨҡиҒҡй…¶пјҲйҖҶиҪ¬еҪ•й…¶пјүзҡ„жүҖжңүдёүз§Қжҙ»жҖ§пјҡпјҲ1пјүHBVеӨҡиҒҡй…¶зҡ„еҗҜеҠЁпјӣпјҲ2пјүеүҚеҹәеӣ з»„mRNAйҖҶиҪ¬еҪ•иҙҹй“ҫзҡ„еҪўжҲҗпјӣпјҲ3пјүHBV-DNAжӯЈй“ҫзҡ„еҗҲжҲҗгҖӮжҒ©жӣҝеҚЎйҹҰдёүзЈ·й…ёзӣҗеҜ№з»Ҷиғһзҡ„αгҖҒβгҖҒδDNAеӨҡиҒҡй…¶е’ҢзәҝзІ’дҪ“γDNAеӨҡиҒҡй…¶жҠ‘еҲ¶дҪңз”ЁиҫғејұпјҢKiеҖјдёә18иҮіеӨ§дәҺ160 μMгҖӮ
3.жҠ—з—…жҜ’жҙ»жҖ§
еңЁиҪ¬жҹ“дәҶйҮҺз”ҹеһӢд№ҷиӮқз—…жҜ’зҡ„дәәзұ»HepG2з»ҶиғһдёӯпјҢжҒ©жӣҝеҚЎйҹҰжҠ‘еҲ¶50пј…з—…жҜ’DNAеҗҲжҲҗжүҖйңҖжө“еәҰпјҲEC50пјүдёә0.004 μMгҖӮжҒ©жӣҝеҚЎйҹҰеҜ№жӢүзұіеӨ«е®ҡиҖҗиҚҜз—…жҜ’ж ӘпјҲrtL180MпјҢrtM204Vпјүзҡ„EC50 зҡ„дёӯдҪҚеҖјжҳҜ0.026 μM(иҢғеӣҙ0.01иҮі0.059 μM)гҖӮ
жҒ©жӣҝеҚЎйҹҰдёҺHIVж ёиӢ·йҖҶиҪ¬еҪ•й…¶жҠ‘еҲ¶еүӮпјҲNRTIsпјүиҒ”еҗҲз»ҷиҚҜпјҢдёҚеӨӘеҸҜиғҪйҷҚдҪҺжҒ©жӣҝеҚЎйҹҰзҡ„жҠ—HBVз–—ж•ҲжҲ–еҗҺдёҖзұ»иҚҜзү©дёӯд»»дҪ•дёҖз§ҚиҚҜзү©зҡ„жҠ—HIVз–—ж•ҲгҖӮз»Ҷиғһеҹ№е…»дёӯжЈҖйӘҢHBVиҒ”еҗҲжІ»з–—пјҢеҸ‘зҺ°еңЁеӨ§иҢғеӣҙжө“еәҰеҶ…пјҢйҳҝе·ҙеҚЎйҹҰпјҢеҺ»зҫҹиӮҢиӢ·пјҢжӢүзұіеӨ«е®ҡпјҢеҸёд»–еӨ«е®ҡпјҢжӣҝиҜәзҰҸйҹҰжҲ–йҪҗеӨҡеӨ«е®ҡеҜ№жҒ©жӣҝеҚЎйҹҰзҡ„жҠ—HBVжҙ»жҖ§еқҮж— жӢ®жҠ—дҪңз”ЁгҖӮеңЁHIVжҠ—з—…жҜ’жҙ»жҖ§е®һйӘҢдёӯпјҢеҪ“жҒ©жӣҝеҚЎйҹҰжө“еәҰеӨ§дәҺдҪ“еҶ…еі°жө“еәҰ4еҖҚж—¶пјҢжҒ©жӣҝеҚЎйҹҰеҜ№дәҺ6з§ҚNRTIsиҚҜзү©зҡ„з»Ҷиғһеҹ№е…»дёӯзҡ„жҠ—HIVжҙ»жҖ§ж— жӢ®жҠ—дҪңз”ЁгҖӮ
4.жҠ—HIVз—…жҜ’жҙ»жҖ§
е…ЁйқўеҲҶжһҗжҒ©жӣҝеҚЎйҹҰеҜ№дёҖз»„е®һйӘҢе®ӨеҲҶзҰ»жҜ’ж Әд»ҘеҸҠдёҙеәҠеҲҶзҰ»зҡ„в… еһӢдәәзұ»е…Қз–«зјәйҷ·жҜ’ж ӘпјҲHIV-1пјүзҡ„жҠ‘еҲ¶жҙ»жҖ§пјҢеңЁдёҚеҗҢз»ҶиғһеҸҠе®һйӘҢжқЎд»¶дёӢиҺ·еҫ—зҡ„EC50еҖјиҢғеӣҙжҳҜ0.026еҲ°>10μMпјӣеҪ“з—…жҜ’ж°ҙе№ійҷҚдҪҺж—¶и§ӮеҜҹеҲ°жӣҙдҪҺзҡ„EC50еҖјгҖӮеңЁз»Ҷиғһеҹ№е…»дёӯпјҢжҒ©жӣҝеҚЎйҹҰеңЁеҫ®ж‘©е°”жө“еәҰж°ҙе№іж—¶еҸҜйҖүжӢ©еҮәHIVйҖҶиҪ¬еҪ•й…¶зҡ„M184 IдҪҚзӮ№зҪ®жҚўпјҢеңЁжҒ©жӣҝеҚЎйҹҰй«ҳжө“еәҰж°ҙе№іж—¶иҜҒе®һдәҶжҠ‘еҲ¶дҪңз”ЁгҖӮеҗ«M184VдҪҚзӮ№зҪ®жҚўзҡ„HIVеҸҳејӮж ӘеҜ№жҒ©жӣҝеҚЎйҹҰеӨұеҺ»ж•Ҹж„ҹжҖ§гҖӮ
5.иҖҗиҚҜжҖ§
пјҲ1пјүз»Ҷиғһеҹ№е…»
дҪҚдәҺйҖҶиҪ¬еҪ•й…¶еҢәжңүrtM204I/Vе’ҢrtL180MдҪҚзӮ№зҪ®жҚўзҡ„жӢүзұіеӨ«е®ҡиҖҗиҚҜж ӘпјҲLVDrпјүеҜ№жҒ©жӣҝеҚЎйҹҰзҡ„ж•Ҹж„ҹжҖ§иҫғHBVйҮҺжҜ’ж ӘдёӢйҷҚдәҶ8еҖҚгҖӮеҗҲ并其他жҒ©жӣҝеҚЎйҹҰиҖҗиҚҜж°Ёеҹәй…ёrtT184пјҢrtS202е’Ң/жҲ–rtM250дҪҚзӮ№ж”№еҸҳзҡ„пјҢеңЁз»Ҷиғһеҹ№е…»иҝҳеҸ‘зҺ°пјҢеҜ№жҒ©жӣҝеҚЎйҹҰзҡ„ж•Ҹж„ҹжҖ§йҷҚдҪҺгҖӮеҗҲ并其他пјҲrtT184AпјҢCпјҢFпјҢGпјҢIпјҢLпјҢMжҲ–SпјӣrtS202 CпјҢGжҲ–Iпјӣе’Ң/жҲ–rtM250IпјҢLжҲ–VпјүдҪҚзӮ№зҪ®жҚўзҡ„дёҙеәҠеҲҶзҰ»ж ӘдёҺйҮҺжҜ’ж ӘзӣёжҜ”пјҢеҜ№жҒ©жӣҝеҚЎйҹҰзҡ„ж•Ҹж„ҹжҖ§иҝӣдёҖжӯҘйҷҚдҪҺдәҶ16иҮі741еҖҚгҖӮеҚ•зӢ¬еҮәзҺ°rtT184пјҢrtS202е’ҢrtM250жҒ©жӣҝеҚЎйҹҰиҖҗиҚҜдҪҚзӮ№зҪ®жҚўзҡ„з—…жҜ’ж ӘеҜ№жҒ©жӣҝеҚЎйҹҰзҡ„ж•Ҹж„ҹжҖ§д»…жңүдёҖе®ҡеҪұе“ҚпјҢеңЁи¶…иҝҮ1000дҫӢжІЎжңүжӢүзұіеӨ«е®ҡиҖҗиҚҜдҪҚзӮ№зҪ®жҚўзҡ„жӮЈиҖ…дёӯжңӘи§ӮеҜҹеҲ°ж•Ҹж„ҹжҖ§йҷҚдҪҺгҖӮз»Ҷиғһеҹ№е…»дёӯеҸ‘зҺ°пјҢиҖҗиҚҜжҖ§жҳҜйҖҡиҝҮж”№еҸҳHBVйҖҶиҪ¬еҪ•й…¶еҮҸе°‘з«һдәүз»“еҗҲиҖҢд»ӢеҜјзҡ„пјҢиҖҗиҚҜзҡ„HBVжҜ’ж ӘеӨҚеҲ¶иғҪеҠӣеҮҸејұгҖӮ
пјҲ2пјүдёҙеәҠз ”з©¶
дёҙеәҠз ”з©¶дёӯеҜ№еҲқе§ӢжҺҘеҸ—жҒ©жӣҝеҚЎйҹҰ0.5 mgпјҲж ёиӢ·еҲқжІ»пјүжҲ–1 mgпјҲжӢүзұіеӨ«е®ҡеӨұж•ҲпјүжІ»з–—пјҢ并且еңЁжІ»з–—24е‘ЁжҲ–д№ӢеҗҺпјҢеҜ№дәҺеңЁжІ»з–—дёӯеҒҡдәҶHBV-DNA PCRжЈҖжөӢзҡ„жӮЈиҖ…еқҮиҝӣиЎҢдәҶиҖҗиҚҜзӣ‘жөӢгҖӮ
ж ёиӢ·зұ»иҚҜзү©еҲқжІ»жӮЈиҖ…пјҡж ёиӢ·зұ»иҚҜзү©еҲқжІ»жӮЈиҖ…з ”з©¶дёӯпјҢжҒ©жӣҝеҚЎйҹҰй•ҝиҫҫ144е‘ЁжІ»з–—еҸ‘зҺ°жңүrtT184гҖҒrt202е’Ң/жҲ–rtM250жҒ©жӣҝеҚЎйҹҰиҖҗиҚҜдҪҚзӮ№зҪ®жҚўеҹәеӣ жЈҖжөӢиҜҒжҚ®зҡ„жӮЈиҖ…жҜ”дҫӢ<1пј…пјҲи§ҒиЎЁ5пјүгҖӮеҸ‘зҺ°иҝҷдәӣдҪҚзӮ№зҡ„зҪ®жҚўд»…еңЁеҮәзҺ°жӢүзұіеӨ«е®ҡиҖҗиҚҜдҪҚзӮ№пјҲrtM204Vе’ҢrtL180Mпјүзҡ„еҹәзЎҖдёҠеҸ‘з”ҹжҒ©жӣҝеҚЎйҹҰиҖҗиҚҜгҖӮ
a 3е№ҙзҡ„з»“жһңеҸҚжҳ 149дҫӢжӮЈиҖ…дёӯжңү147дҫӢеңЁжҒ©жӣҝеҚЎйҹҰ延з»ӯжІ»з–—з ”з©¶дёӯжҺҘеҸ—дәҶжҒ©жӣҝеҚЎйҹҰ1.0mgжІ»з–—пјҢеҗҢж—¶жңү130дҫӢжҺҘеҸ—дәҶдёӯдҪҚж—¶й—ҙеңЁ20е‘Ёзҡ„жҒ©жӣҝеҚЎйҹҰе’ҢжӢүзұіеӨ«е®ҡзҡ„иҒ”еҗҲжІ»з–—пјҲйҡҸеҗҺжҺҘеҸ—жҒ©жӣҝеҚЎйҹҰй•ҝжңҹжІ»з–—пјүгҖӮ
b еҢ…жӢ¬ж•ҙдёӘз ”з©¶58е‘ЁпјҲ1е№ҙпјүеңЁз¬¬24е‘Ёж—¶жҲ–д№ӢеҗҺпјҢж•ҙдёӘз ”з©¶58е‘ЁиҮі102е‘ЁпјҲ2е№ҙпјүй—ҙпјҢжҲ–ж•ҙдёӘз ”з©¶102е‘ЁиҮі156е‘Ёй—ҙпјҢеңЁжІ»з–—дёӯиҝӣиЎҢдәҶHBV-DNA PCRжЈҖжөӢзҡ„жӮЈиҖ…гҖӮ
c жӮЈиҖ…еҗҢж—¶жңүжӢүзұіеӨ«е®ҡиҖҗиҚҜдҪҚзӮ№зҪ®жҚўгҖӮ
d PCRжЈҖжөӢHBV-DNAиҮӘжңҖдҪҺзӮ№дёҠеҚҮ≥1 log10пјҢз”ұиҝһз»ӯжЈҖжөӢзЎ®и®ӨжҲ–еңЁж—¶й—ҙзӘ—з»“жқҹж—¶еҫ—еҲ°зҡ„жЈҖжөӢеҖјгҖӮ
жӢүзұіеӨ«е®ҡжІ»з–—еӨұж•Ҳзҡ„жӮЈиҖ…пјҡеңЁжӢүзұіеӨ«е®ҡжІ»з–—еӨұж•ҲеҗҺпјҢз”ЁжҒ©жӣҝеҚЎйҹҰ治疗并иҝӣиЎҢиҖҗиҚҜзӣ‘жөӢзҡ„жӮЈиҖ…дёӯпјҢе…¶еҹәзәҝз—…жҜ’еҲҶзҰ»ж ӘдёӯеҸ‘зҺ°е·ІжңүжҒ©жӣҝеҚЎйҹҰиҖҗиҚҜдҪҚзӮ№зҪ®жҚўзҡ„187дҫӢдёӯжңү10дҫӢпјҢеҚ 5пј…пјҢжҳҫзӨәд№ӢеүҚжӢүзұіеӨ«е®ҡжІ»з–—иғҪеӨҹйҖүжӢ©еҮәиҝҷдәӣиҖҗиҚҜдҪҚзӮ№е№¶еңЁжҒ©жӣҝеҚЎйҹҰжІ»з–—еүҚд»ҘдҪҺж°ҙе№ізҠ¶жҖҒеӯҳеңЁгҖӮж•ҙдёӘз ”з©¶144е‘ЁпјҢ10дҫӢжӮЈиҖ…дёӯжңү3дҫӢеҸ‘з”ҹдәҶз—…жҜ’еӯҰеҸҚеј№пјҲиҫғжңҖдҪҺзӮ№дёҠеҚҮ≥1 log10пјүгҖӮж•ҙдёӘ144е‘ЁжӢүзұіеӨ«е®ҡжІ»з–—еӨұж•Ҳзҡ„жӮЈиҖ…з ”з©¶дёӯпјҢеҸ‘з”ҹжҒ©жӣҝеҚЎйҹҰиҖҗиҚҜзҡ„жғ…еҶөеңЁиЎЁ6дёӯжҰӮжӢ¬гҖӮ
![ячbҫ–·уN<ЧйҘҫ|Чn9у]6Ы]6ЧһҮ�PН�р‘юҡ\юҡ]<$G�PН��ө–Ҳ5Уъi{ъiлъi®У6УӮ?VҷnІiлҙҪ|РББT3@у}+ҙНҙаҸХҰ[¬ҡzн/_42»KуB?V»UЧҪЛ®УvЯӨлҙ
|Х]7ЧQБWъiюҡuюҡ@ҷл�4�й§oй§Қфҡ�дғ]&ғяtЯҹй§m4Ч© юH?ЧI яo6ЧmхУMtҡ�ьу}wЧI яЮ?Ұҹй§й§]&ғю6Яҹй§~4гFЎӯз](http://img.360bzl.com/images/upload/Image/31184421-9235.PNG)
иӮҝзҳӨзҡ„еҸ‘з”ҹзҺҮеўһеҠ гҖӮеҪ“еүӮйҮҸиҮідәәдҪ“еүӮйҮҸзҡ„3еҖҚж—¶пјҢйӣ„жҖ§е°Ҹйј иӮәйғЁи…әзҳӨе’Ң
иӮҝзҳӨеҸ‘з”ҹзҺҮеўһеҠ пјӣеҪ“еүӮйҮҸиҮідәәдҪ“еүӮйҮҸзҡ„40еҖҚж—¶пјҢйӣ„жҖ§е°Ҹйј зҡ„иӮәйғЁи…әзҳӨе’ҢиӮҝзҳӨеҸ‘з”ҹзҺҮеўһеҠ гҖӮе°Ҹйј е…ҲеҮәзҺ°иӮәз»Ҷиғһеўһз”ҹпјҢ继иҖҢеҮәзҺ°иӮәйғЁиӮҝзҳӨпјҢдҪҶз»ҷдәҲжң¬е“Ғзҡ„еӨ§йј гҖҒзӢ—е’ҢзҢҙдёӯ并жңӘеҸ‘зҺ°иӮәз»Ҷиғһеўһз”ҹпјҢиҝҷжҸҗзӨәеңЁе°Ҹйј дҪ“еҶ…еҸ‘з”ҹзҡ„иӮәйғЁиӮҝзҳӨеҸҜиғҪе…·жңүз§Қеұһзү№ејӮжҖ§гҖӮеҪ“еүӮйҮҸиҮідәәдҪ“еүӮйҮҸзҡ„42еҖҚж—¶пјҢйӣ„жҖ§е°Ҹйј зҡ„иӮқз»ҶиғһиӮҝзҳӨдёҺж··еҗҲзҳӨпјҲиӮҝзҳӨе’Ңи…әзҳӨпјүзҡ„еҸ‘з”ҹзҺҮеўһеҠ гҖӮеҪ“еүӮйҮҸиҮідәәдҪ“еүӮйҮҸзҡ„40еҖҚж—¶пјҢйӣҢжҖ§е°Ҹйј зҡ„иЎҖз®ЎжҖ§иӮҝзҳӨпјҲеҢ…жӢ¬еҚөе·ўпјҢеӯҗе®«зҡ„иЎҖз®ЎзҳӨе’Ңи„ҫи„Ҹзҡ„иЎҖз®ЎиӮүзҳӨпјүеҸ‘з”ҹзҺҮеўһеҠ гҖӮеңЁеӨ§йј зҡ„иҜ•йӘҢдёӯпјҢеҪ“еүӮйҮҸиҮідәәдҪ“еүӮйҮҸзҡ„24еҖҚж—¶пјҢйӣҢжҖ§еӨ§йј зҡ„иӮқз»Ҷиғһи…әзҳӨзҡ„еҸ‘з”ҹзҺҮеўһеҠ пјҢж··еҗҲзҳӨпјҲиӮҝзҳӨе’Ңи…әзҳӨпјүзҡ„еҸ‘з”ҹзҺҮд№ҹеўһеҠ гҖӮеҪ“еүӮйҮҸиҮідәәдҪ“еүӮйҮҸзҡ„35еҖҚе’Ң24еҖҚж—¶пјҢеҲҶеҲ«еңЁйӣ„жҖ§еӨ§йј е’ҢйӣҢжҖ§еӨ§йј иә«дёҠеҸ‘зҺ°жңүи„‘иғ¶иҙЁзҳӨгҖӮеҪ“еүӮйҮҸиҮідәәдҪ“еүӮйҮҸзҡ„4еҖҚж—¶пјҢеңЁйӣҢжҖ§еӨ§йј иә«дёҠеҸ‘зҺ°жңүзҡ®иӮӨзәӨз»ҙзҳӨгҖӮ
зӣ®еүҚе°ҡдёҚжё…жҘҡжң¬е“Ғе•®йҪҝзұ»еҠЁзү©иҮҙзҷҢжҖ§иҜ•йӘҢзҡ„з»“жһңиғҪеҗҰйў„жөӢжң¬е“ҒеҜ№дәәдҪ“зҡ„иҮҙзҷҢдҪңз”ЁгҖӮ
гҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘
еҗёж”¶пјҡ еҒҘеә·еҸ—иҜ•иҖ…еҸЈжңҚз”ЁиҚҜеҗҺпјҢжң¬е“Ғиў«иҝ…йҖҹеҗёж”¶пјҢ0.5еҲ°1.5е°Ҹж—¶иҫҫеҲ°еі°жө“еәҰпјҲCmaxпјүгҖӮжҜҸеӨ©з»ҷиҚҜдёҖж¬ЎпјҢ6—10еӨ©еҗҺеҸҜиҫҫзЁіжҖҒпјҢзҙҜз§ҜйҮҸзәҰдёәдёӨеҖҚгҖӮ
йЈҹзү©еҜ№еҸЈжңҚеҗёж”¶зҡ„еҪұе“Қ пјҡиҝӣйЈҹж ҮеҮҶй«ҳи„ӮйӨҗжҲ–дҪҺи„ӮйӨҗзҡ„еҗҢж—¶еҸЈжңҚ0.5mgжң¬е“ҒдјҡеҜјиҮҙиҚҜзү©еҗёж”¶зҡ„иҪ»еҫ®е»¶иҝҹпјҲд»ҺеҺҹжқҘзҡ„0.75е°Ҹж—¶еҸҳдёә1.0—1.5е°Ҹж—¶пјүпјҢCmaxйҷҚдҪҺ44—46%пјҢиҚҜж—¶жӣІзәҝдёӢйқўз§ҜпјҲAUCпјүйҷҚдҪҺ18—20%гҖӮеӣ жӯӨпјҢжң¬е“Ғеә”з©әи…№жңҚз”ЁпјҲйӨҗеүҚжҲ–йӨҗеҗҺиҮіе°‘2е°Ҹж—¶пјүгҖӮ
еҲҶеёғпјҡ иҚҜд»ЈеҠЁеҠӣеӯҰиө„ж–ҷиЎЁжҳҺпјҢе…¶иЎЁи§ӮеҲҶеёғе®№з§Ҝи¶…иҝҮе…Ёиә«ж¶ІдҪ“йҮҸпјҢиҝҷиҜҙжҳҺжң¬е“Ғе№ҝжіӣеҲҶеёғдәҺеҗ„з»„з»ҮгҖӮ дҪ“еӨ–е®һйӘҢиЎЁжҳҺжң¬е“ҒдёҺдәәиЎҖжөҶиӣӢзҷҪз»“еҗҲзҺҮдёә13%гҖӮ
д»Ји°ўе’Ңжё…йҷӨ пјҡ
еңЁз»ҷдәәе’ҢеӨ§йј жңҚз”Ё14Cж Үи®°зҡ„жҒ©жӣҝеҚЎйҹҰеҗҺпјҢжңӘи§ӮеҜҹеҲ°жң¬е“Ғзҡ„ж°§еҢ–жҲ–д№ҷй…°еҢ–д»Ји°ўзү©пјҢдҪҶи§ӮеҜҹеҲ°е°‘йҮҸIIжңҹд»Ји°ўдә§зү©и‘Ўиҗ„зі–йҶӣй…ёз”ҷз»“еҗҲзү©е’ҢзЎ«й…ёз»“еҗҲзү©гҖӮжҒ©жӣҝеҚЎйҹҰдёҚжҳҜз»ҶиғһиүІзҙ P450пјҲCYP450пјүй…¶зі»з»ҹзҡ„еә•зү©гҖҒжҠ‘еҲ¶еүӮжҲ–иҜұеҜјеүӮгҖӮ
еңЁиҫҫеҲ°иЎҖжөҶеі°жө“еәҰеҗҺпјҢиЎҖиҚҜжө“еәҰд»ҘеҸҢжҢҮж•°ж–№ејҸдёӢйҷҚпјҢиҫҫеҲ°з»Ҳжң«жё…йҷӨеҚҠиЎ°жңҹзәҰйңҖ128—149е°Ҹж—¶гҖӮиҚҜзү©зҙҜз§ҜжҢҮж•°зәҰдёәжҜҸеӨ©дёҖж¬Ўз»ҷиҚҜеүӮйҮҸзҡ„2еҖҚпјҢиҝҷиЎЁжҳҺе…¶жңүж•ҲзҙҜз§ҜеҚҠиЎ°жңҹзәҰдёә24е°Ҹж—¶гҖӮ
жң¬е“Ғдё»иҰҒд»ҘеҺҹеҪўйҖҡиҝҮиӮҫи„Ҹжё…йҷӨпјҢжё…йҷӨзҺҮдёәз»ҷиҚҜйҮҸзҡ„62—73%гҖӮиӮҫжё…йҷӨзҺҮдёә360—471mL/minпјҢдё”дёҚдҫқиө–дәҺз»ҷиҚҜеүӮйҮҸпјҢиҝҷиЎЁжҳҺжҒ©жӣҝеҚЎйҹҰеҗҢж—¶йҖҡиҝҮиӮҫе°Ҹзҗғж»ӨиҝҮе’ҢзҪ‘зҠ¶е°Ҹз®ЎеҲҶжіҢгҖӮ
зү№ж®ҠдәәзҫӨ
жҖ§еҲ«пјҡжң¬е“Ғзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰдёҚеӣ жҖ§еҲ«зҡ„дёҚеҗҢиҖҢж”№еҸҳгҖӮ
з§Қж—Ҹпјҡжң¬е“Ғзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰдёҚеӣ з§Қж—Ҹзҡ„дёҚеҗҢиҖҢж”№еҸҳгҖӮ
иҖҒе№ҙдәәпјҡдёҖйЎ№иҜ„д»·е№ҙйҫ„дёҺжң¬е“ҒиҚҜд»ЈеҠЁеҠӣеӯҰе…ізі»зҡ„з ”з©¶пјҲеҸЈжңҚжң¬е“Ғ1mgпјүжҳҫзӨәиҖҒе№ҙдәәзҡ„AUCиҫғеҒҘеә·е№ҙиҪ»дәәеҚҮй«ҳ29.3%пјҢиҝҷеҫҲеҸҜиғҪжҳҜз”ұдәҺдёӘдҪ“иӮҫеҠҹиғҪзҡ„е·®ејӮжүҖйҖ жҲҗзҡ„гҖӮиҖҒе№ҙдәәзҡ„з”ЁиҚҜеүӮйҮҸеҸӮзңӢиӮҫеҠҹиғҪдёҚе…ЁиҖ…зҡ„еүӮйҮҸи°ғиҠӮгҖӮ
иӮҫеҠҹиғҪдёҚе…Ёпјҡ еңЁдёҚеҗҢзЁӢеәҰиӮҫеҠҹиғҪдёҚе…Ёзҡ„жӮЈиҖ…пјҲж— ж…ўжҖ§д№ҷеһӢиӮқзӮҺз—…жҜ’ж„ҹжҹ“пјүпјҢеҢ…жӢ¬дҪҝз”ЁиЎҖж¶ІйҖҸжһҗжҲ–CAPDжІ»з–—зҡ„жӮЈиҖ…дёӯпјҢеҚ•ж¬Ўз»ҷиҚҜ1mg жң¬е“ҒеҗҺзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰз»“жһңжҳҫзӨәжё…йҷӨзҺҮйҡҸиӮҢй…җжё…йҷӨзҺҮзҡ„йҷҚдҪҺиҖҢдёӢйҷҚгҖӮиЎҖж¶ІйҖҸжһҗеүҚ2е°Ҹж—¶еҚ•ж¬Ўз»ҷиҚҜ1mgжң¬е“ҒпјҢиЎҖж¶ІйҖҸжһҗ4е°Ҹж—¶иғҪжё…йҷӨзәҰз»ҷиҚҜеүӮйҮҸзҡ„13%пјҢCAPDжІ»з–—7еӨ©д»…иғҪжё…йҷӨзәҰз»ҷиҚҜеүӮйҮҸзҡ„0.3%гҖӮжҒ©жӣҝеҚЎйҹҰеә”еңЁиЎҖж¶ІйҖҸжһҗеҗҺз»ҷиҚҜгҖӮ
иӮқеҠҹиғҪдёҚе…Ёпјҡ еңЁдёӯеәҰе’ҢйҮҚеәҰиӮқеҠҹиғҪдёҚе…ЁпјҲChild—PughеҲҶзә§BжҲ–Cпјүзҡ„жӮЈиҖ…пјҲдёҚеҢ…жӢ¬ж…ўжҖ§д№ҷиӮқз—…жҜ’ж„ҹжҹ“жӮЈиҖ…пјүдёӯпјҢз ”з©¶дәҶеҚ•ж¬Ўз»ҷиҚҜ1 mgеҗҺжҒ©жӣҝеҚЎйҹҰзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰпјҢиӮқеҠҹиғҪдёҚе…Ёзҡ„жӮЈиҖ…дёҺеҒҘеә·еҜ№з…§жӮЈиҖ…зҡ„жҒ©жӣҝеҚЎйҹҰзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰжғ…еҶөзӣёдјјгҖӮеӣ жӯӨпјҢж— йңҖеңЁиӮқеҠҹиғҪдёҚе…ЁжӮЈиҖ…дёӯи°ғиҠӮжҒ©жӣҝеҚЎйҹҰзҡ„з»ҷиҚҜеүӮйҮҸгҖӮ
иӮқ移жӨҚеҗҺпјҡ зӣ®еүҚе°ҡдёҚжё…жҘҡжң¬е“ҒеңЁиӮқ移жӨҚжӮЈиҖ…дёӯзҡ„е®үе…ЁжҖ§е’Ңжңүж•ҲжҖ§гҖӮдёҖдёӘе°ҸеһӢзҡ„з ”з©¶дёӯпјҢеңЁдҪҝз”ЁзЁіе®ҡеүӮйҮҸзҡ„зҺҜеӯўй…¶зҙ AпјҲn=5пјүжҲ–д»–е…ӢиҺ«еҸёпјҲn=4пјүжІ»з–—HBV ж„ҹжҹ“иӮқ移жӨҚжӮЈиҖ…дёӯпјҢз”ұдәҺиӮҫеҠҹиғҪзҡ„ж”№еҸҳпјҢжң¬е“ҒеңЁдҪ“еҶ…зҡ„жҖ»йҮҸзәҰдёәиӮҫеҠҹиғҪжӯЈеёёзҡ„еҒҘеә·дәәзҡ„дёӨеҖҚгҖӮиӮҫеҠҹиғҪзҡ„ж”№еҸҳжҳҜеҜјиҮҙжң¬е“ҒеңЁиҝҷдәӣжӮЈиҖ…дёӯжө“еәҰеўһеҠ зҡ„еҺҹеӣ гҖӮжң¬е“ҒдёҺзҺҜеӯўй…¶зҙ AжҲ–д»–е…ӢиҺ«еҸёд№Ӣй—ҙзҡ„иҚҜзү©еҠЁеҠӣеӯҰзҡ„зӣёдә’дҪңз”Ёе°ҡжңӘиў«жӯЈејҸиҜ„д»·гҖӮеҜ№дәҺжӣҫз»ҸжҲ–жӯЈеңЁжҺҘеҸ—еҸҜиғҪеҪұе“ҚиӮҫеҠҹиғҪзҡ„е…Қз–«жҠ‘еҲ¶еүӮпјҢеҰӮпјҡзҺҜеӯўй…¶зҙ AжҲ–д»–е…ӢиҺ«еҸёпјҢжІ»з–—зҡ„иӮқ移жӨҚеҸ—дҪ“жӮЈиҖ…пјҢжҺҘеҸ—жҒ©жӣҝеҚЎйҹҰжІ»з–—еүҚе’ҢжІ»з–—дёӯпјҢеә”иҜҘдёҘеҜҶзӣ‘жөӢиӮҫеҠҹиғҪпјҲи§ҒгҖҗз”Ёжі•з”ЁйҮҸгҖ‘йЎ№дёӢиӮҫеҠҹиғҪдёҚе…ЁжӮЈиҖ…зҡ„еүӮйҮҸи°ғж•ҙпјүгҖӮ
е„ҝз«Ҙз”ЁиҚҜ пјҡе°ҡж— е„ҝз«ҘдҪҝз”ЁиҜҘиҚҜзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰж•°жҚ®гҖӮ
гҖҗиҙ®и—ҸгҖ‘еҜҶе°ҒпјҢеңЁ25в„ғд»ҘдёӢе№ІзҮҘеӨ„дҝқеӯҳгҖӮ
гҖҗеҢ…иЈ…гҖ‘й“қеЎ‘еҢ…иЈ…гҖӮ7зүҮ/жқҝпјҢжҜҸзӣ’1жқҝгҖӮ
гҖҗжңүж•ҲжңҹгҖ‘36дёӘжңҲгҖӮ
гҖҗз”ҹдә§дјҒдёҡгҖ‘жө·еҚ—дёӯе’ҢиҚҜдёҡжңүйҷҗе…¬еҸё














 е®ҳж–№еҫ®дҝЎ
е®ҳж–№еҫ®дҝЎ
 жүӢжңәе•ҶеҹҺ
жүӢжңәе•ҶеҹҺ