гҖҗе•Ҷе“ҒеҗҚгҖ‘
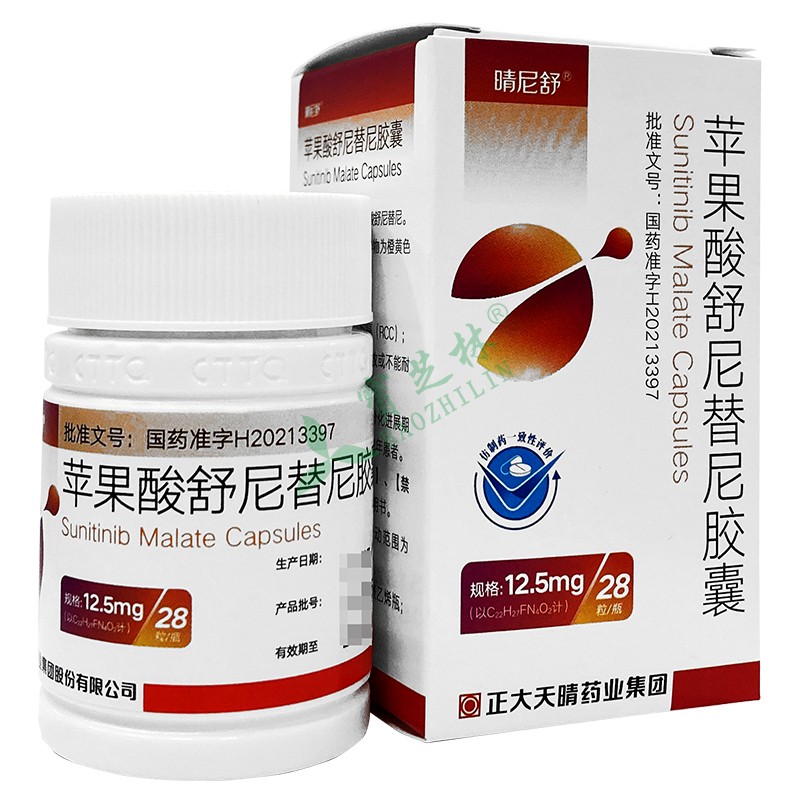
гҖҗдә§е“ҒеҗҚз§°гҖ‘иӢ№жһңй…ёиҲ’е°јжӣҝе°јиғ¶еӣҠ
гҖҗиӢұж–ҮеҗҚгҖ‘SunitinibMalateCapsules
гҖҗжұүиҜӯжӢјйҹігҖ‘PingGuoSuanShuNiTiNiJiaoNang
гҖҗжҲҗд»ҪгҖ‘
жң¬е“Ғдё»иҰҒжҲҗд»ҪеҸҠе…¶еҢ–еӯҰеҗҚз§°дёәпјҡ
(Z)-N-[2-(дәҢд№ҷиғәеҹә)д№ҷеҹә-5-[(5-ж°ҹ-2-ж°§д»Ј-1,2-дәҢж°ў-3H-еҗІе“ҡ-3-дәҡеҹә)з”Іеҹә]-2,4-дәҢз”Іеҹә-3-ж°Ёз”Ій…°-1H-еҗЎе’ҜиӢ№жһңй…ёзӣҗ
е…¶з»“жһ„ејҸдёәпјҡ

еҲҶеӯҗејҸпјҡC22H27FN4O2В·C4H6O5
еҲҶеӯҗйҮҸпјҡ532.6
иҫ…ж–ҷеҗҚз§°пјҡз”ҳйңІйҶҮгҖҒиҒҡд№ҷзғҜеҗЎе’Ҝзғ·й…®гҖҒдәӨиҒ”зҫ§з”ІеҹәзәӨз»ҙзҙ й’ гҖҒзЎ¬и„Ӯй…ёй•Ғ
гҖҗжҖ§зҠ¶гҖ‘
жң¬е“Ғдёәиғ¶еӣҠеүӮпјҢеҶ…е®№зү©дёәй»„иүІиҮіж©ҷиүІзҡ„йў—зІ’гҖӮ
гҖҗйҖӮеә”з—ҮгҖ‘
1пјүдёҚиғҪжүӢжңҜзҡ„жҷҡжңҹиӮҫз»ҶиғһзҷҢпјҲRCCпјү
2пјүз”ІзЈәй…ёдјҠ马жӣҝе°јжІ»з–—еӨұиҙҘжҲ–дёҚиғҪиҖҗеҸ—зҡ„иғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјү
3пјүдёҚеҸҜеҲҮйҷӨзҡ„пјҢиҪ¬з§»жҖ§й«ҳеҲҶеҢ–иҝӣеұ•жңҹиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјҲpNETпјүжҲҗе№ҙжӮЈиҖ…гҖӮ
гҖҗз”Ёжі•з”ЁйҮҸгҖ‘
<
иҲ’е°јжӣҝе°јжІ»з–—иғғиӮ й—ҙиҙЁзҳӨе’ҢжҷҡжңҹиӮҫз»ҶиғһзҷҢзҡ„жҺЁиҚҗеүӮйҮҸжҳҜ50mgпјҢжҜҸж—ҘдёҖж¬ЎпјҢеҸЈжңҚпјҢжңҚиҚҜ4е‘ЁпјҢеҒңиҚҜ2е‘ЁпјҲ4/2з»ҷиҚҜж–№жЎҲпјүгҖӮ
еҜ№дәҺиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјҢиҲ’е°јжӣҝе°јжҺЁиҚҗеүӮйҮҸдёә37.5mgпјҢеҸЈжңҚпјҢжҜҸж—ҘдёҖж¬ЎпјҢиҝһз»ӯжңҚиҚҜпјҢж— еҒңиҚҜжңҹгҖӮ
дёҺйЈҹзү©еҗҢжңҚжҲ–дёҚеҗҢжңҚеқҮеҸҜгҖӮ
еүӮйҮҸи°ғж•ҙ
е®үе…ЁжҖ§е’ҢиҖҗеҸ—жҖ§
еҜ№дәҺиғғиӮ й—ҙиҙЁзҳӨе’ҢиҪ¬з§»жҖ§иӮҫз»ҶиғһзҷҢпјҢж №жҚ®жӮЈиҖ…дёӘдҪ“зҡ„е®үе…ЁжҖ§е’ҢиҖҗеҸ—жҖ§пјҢд»Ҙ12.5mgдёәжўҜеәҰеҚ•дҪҚйҖҗжӯҘи°ғж•ҙеүӮйҮҸгҖӮжҜҸж—ҘжңҖй«ҳеүӮйҮҸдёҚи¶…иҝҮ75mgпјҢжңҖдҪҺеүӮйҮҸдёә25mgгҖӮ
еҜ№дәҺиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјҢж №жҚ®жӮЈиҖ…дёӘдҪ“зҡ„е®үе…ЁжҖ§е’ҢиҖҗеҸ—жҖ§пјҢд»Ҙ12.5mgдёәжўҜеәҰеҚ•дҪҚйҖҗжӯҘи°ғж•ҙеүӮйҮҸгҖӮеңЁ3жңҹдёҙеәҠиҜ•йӘҢдёӯдҪҝз”Ёзҡ„жңҖеӨ§еүӮйҮҸдёәжҜҸж—Ҙ50mgгҖӮ
ж №жҚ®жӮЈиҖ…дёӘдҪ“зҡ„е®үе…ЁжҖ§е’ҢиҖҗеҸ—жҖ§жғ…еҶөеҸҜиғҪйңҖиҰҒдёӯж–ӯжІ»з–—гҖӮ
CYP3A4ејәжҠ‘еҲ¶еүӮпјҲеҰӮй…®еә·е”‘пјүеҸҜеўһеҠ иҲ’е°јжӣҝе°јзҡ„иЎҖжөҶжө“еәҰгҖӮе»әи®®еҗҲ并用иҚҜж—¶йҖүжӢ©еҜ№жӯӨзұ»й…¶жІЎжңүжҲ–жҠ‘еҲ¶дҪңз”ЁжңҖе°Ҹзҡ„иҚҜзү©гҖӮеҰӮжһңеҝ…йЎ»дёҺCYP3A4ејәжҠ‘еҲ¶еүӮеҗҲ并дҪҝз”ЁпјҢеә”иҖғиҷ‘йҷҚдҪҺиҲ’е°јжӣҝе°јзҡ„еүӮйҮҸпјҢжңҖе°ҸеҸҜиҮі37.5mgпјҢжҜҸж—ҘдёҖж¬ЎпјҲиғғиӮ й—ҙиҙЁзҳӨе’ҢиӮҫз»ҶиғһзҷҢпјүпјҢ25mgпјҢжҜҸж—ҘдёҖж¬ЎпјҲиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјүпјҲи§ҒгҖҗиҚҜзү©зӣёдә’дҪңз”ЁгҖ‘пјүгҖӮ
CYP3A4иҜұеҜјеүӮпјҲеҰӮеҲ©зҰҸе№іпјүеҸҜйҷҚдҪҺиҲ’е°јжӣҝе°јзҡ„иЎҖжөҶжө“еәҰгҖӮе»әи®®еҗҲ并用иҚҜж—¶йҖүжӢ©еҜ№жӯӨзұ»й…¶жІЎжңүжҲ–иҜұеҜјдҪңз”ЁжңҖе°Ҹзҡ„иҚҜзү©гҖӮеҰӮжһңеҝ…йЎ»дёҺCYP3A4иҜұеҜјеүӮеҗҲ并дҪҝз”ЁпјҢеә”иҖғиҷ‘еўһеҠ иҲ’е°јжӣҝе°јзҡ„еүӮйҮҸпјҢжңҖеӨ§еүӮйҮҸдёҚеә”и¶…иҝҮ87.5mgпјҢжҜҸж—ҘдёҖж¬ЎпјҲиғғиӮ й—ҙиҙЁзҳӨе’ҢиӮҫз»ҶиғһзҷҢпјүпјҢ62.5mgпјҢжҜҸж—ҘдёҖж¬ЎпјҲиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјүгҖӮеҰӮжһңеўһеҠ иҲ’е°јжӣҝе°јеүӮйҮҸпјҢеә”д»”з»Ҷзӣ‘жөӢжӮЈиҖ…зҡ„жҜ’жҖ§еҸҚеә”пјҲи§ҒгҖҗиҚҜзү©зӣёдә’дҪңз”ЁгҖ‘пјүгҖӮ
гҖҗиҚҜзҗҶжҜ’зҗҶгҖ‘
иҚҜзҗҶдҪңз”Ё
иӢ№жһңй…ёиҲ’е°јжӣҝе°јжҳҜдёҖз§ҚиғҪжҠ‘еҲ¶еӨҡдёӘеҸ—дҪ“й…Әж°Ёй…ёжҝҖй…¶пјҲRTKпјүзҡ„е°ҸеҲҶеӯҗпјҢе…¶дёӯжҹҗдәӣеҸ—дҪ“й…Әж°Ёй…ёжҝҖй…¶еҸӮдёҺиӮҝзҳӨз”ҹй•ҝгҖҒз—…зҗҶжҖ§иЎҖз®ЎеҪўжҲҗе’ҢиӮҝзҳӨиҪ¬з§»зҡ„иҝҮзЁӢгҖӮйҖҡиҝҮеҜ№иҲ’е°јжӣҝе°јжҠ‘еҲ¶еҗ„з§ҚжҝҖй…¶пјҲ80еӨҡз§ҚжҝҖй…¶пјүзҡ„жҙ»жҖ§иҝӣиЎҢиҜ„д»·пјҢиҜҒжҳҺиҲ’е°јжӣҝе°јеҸҜжҠ‘еҲ¶иЎҖе°ҸжқҝиЎҚз”ҹз”ҹй•ҝеӣ еӯҗеҸ—дҪ“пјҲPDGFRОұе’ҢPDGFRОІпјүгҖҒиЎҖз®ЎеҶ…зҡ®з”ҹй•ҝеӣ еӯҗеҸ—дҪ“пјҲVEGFR1гҖҒVEGFR2е’ҢVEGFR3пјүгҖҒе№Із»Ҷиғһеӣ еӯҗеҸ—дҪ“пјҲKITпјүгҖҒFmsж ·й…Әж°Ёй…ёжҝҖй…¶-3пјҲFLT3пјүгҖҒ1еһӢйӣҶиҗҪеҲәжҝҖеӣ еӯҗеҸ—дҪ“пјҲCSF-1Rпјүе’ҢзҘһз»Ҹиғ¶иҙЁз»Ҷиғһзі»иЎҚз”ҹзҡ„зҘһз»ҸиҗҘе…»еӣ еӯҗеҸ—дҪ“пјҲRETпјүгҖӮз”ҹеҢ–е’Ңз»ҶиғһжөӢе®ҡиҜҒе®һиҲ’е°јжӣҝе°јиғҪжҠ‘еҲ¶иҝҷдәӣеҸ—дҪ“й…Әж°Ёй…ёжҝҖй…¶пјҲRTKпјүзҡ„жҙ»жҖ§пјҢ并еңЁз»Ҷиғһеўһж®–жөӢе®ҡдёӯиҜҒжҳҺдәҶиҲ’е°јжӣҝе°јзҡ„жҠ‘еҲ¶дҪңз”ЁгҖӮз”ҹеҢ–е’Ңз»ҶиғһжөӢе®ҡиЎЁжҳҺдё»иҰҒд»Ји°ўзү©дёҺиҲ’е°јжӣҝе°јжҙ»жҖ§зӣёдјјгҖӮ
еңЁиЎЁиҫҫеҸ—дҪ“й…Әж°Ёй…ёжҝҖй…¶йқ¶зӮ№зҡ„иӮҝзҳӨжЁЎеһӢзҡ„дҪ“еҶ…иҜ•йӘҢдёӯпјҢиҲ’е°јжӣҝе°јиғҪжҠ‘еҲ¶еӨҡдёӘеҸ—дҪ“й…Әж°Ёй…ёжҝҖй…¶пјҲPDGFRОІгҖҒVEGFR2гҖҒKITпјүзҡ„зЈ·й…ёеҢ–иҝӣзЁӢпјӣеңЁжҹҗдәӣеҠЁзү©иӮҝзҳӨжЁЎеһӢдёӯжҳҫзӨәеҮәжҠ‘еҲ¶иӮҝзҳӨз”ҹй•ҝжҲ–еҜјиҮҙиӮҝзҳӨж¶ҲйҖҖпјҢе’Ң/жҲ–жҠ‘еҲ¶иӮҝзҳӨиҪ¬з§»зҡ„дҪңз”ЁгҖӮдҪ“еӨ–е®һйӘҢз»“жһңиЎЁжҳҺиӢ№жһңй…ёиҲ’е°јжӣҝе°јиғҪжҠ‘еҲ¶йқ¶еҗ‘еҸ—дҪ“й…Әж°Ёй…ёжҝҖй…¶пјҲPDGFRгҖҒRETжҲ–KITпјүиЎЁиҫҫеӨұи°ғзҡ„иӮҝзҳӨз»Ҷиғһз”ҹй•ҝпјҢдҪ“еҶ…иҜ•йӘҢз»“жһңиЎЁжҳҺе…¶иғҪжҠ‘еҲ¶PDGFRОІ-е’ҢVEGFR2-дҫқиө–зҡ„иӮҝзҳӨиЎҖз®ЎеҪўжҲҗгҖӮ
жҜ’зҗҶз ”з©¶
йҒ—дј жҜ’жҖ§пјҡиҲ’е°јжӣҝе°јAmesиҜ•йӘҢгҖҒдәәж·Ӣе·ҙз»Ҷиғһжҹ“иүІдҪ“з•ёеҸҳе’ҢеӨ§йј йӘЁй«“еҫ®ж ёиҜ•йӘҢз»“жһңеқҮдёәйҳҙжҖ§гҖӮ
з”ҹж®–жҜ’жҖ§пјҡ
еңЁйӣҢжҖ§з”ҹиӮІеҠӣе’Ңж—©жңҹиғҡиғҺеҸ‘иӮІжҜ’жҖ§иҜ•йӘҢдёӯпјҢйӣҢжҖ§еӨ§йј еңЁдәӨй…ҚеүҚ21еӨ©иҮідәӨй…ҚеҗҺ7еӨ©з»ҸеҸЈз»ҷдәҲиҲ’е°јжӣҝе°јпјҲ0.5гҖҒ1.5гҖҒ5mg/kg/ж—ҘпјүгҖӮ5mg/kg/ж—ҘеүӮйҮҸж—¶пјҲзәҰдёәRDDж—¶AUCзҡ„5еҖҚпјүи§ӮеҜҹеҲ°зқҖеәҠеүҚдёўеӨұгҖӮеңЁвүӨ1.5mg/kg/ж—ҘеүӮйҮҸж—¶пјҲзәҰдёәRDDж—¶AUCзҡ„1еҖҚпјүжңӘи§ӮеҜҹеҲ°еҜ№з”ҹиӮІеҠӣзҡ„дёҚиүҜеҪұе“ҚгҖӮ3дёӘжңҲзҢҙйҮҚеӨҚз»ҸеҸЈз»ҷиҚҜжҜ’жҖ§иҜ•йӘҢпјҲ2гҖҒ6гҖҒ12mg/kg/ж—ҘпјүдёӯпјҢ12mg/kg/ж—ҘеүӮйҮҸпјҲзәҰдёәRDDж—¶AUCзҡ„5еҖҚпјүдёӢеҸҜи§ҒйӣҢжҖ§еҠЁзү©еҚөе·ўеҚөжіЎеҸ‘иӮІдёӢйҷҚпјӣеңЁвүҘ2mg/kg/ж—ҘеүӮйҮҸпјҲзәҰдёәRDDж—¶AUCзҡ„0.4еҖҚпјүдёӢеҸҜи§Ғеӯҗе®«еҶ…иҶңиҗҺзј©гҖӮ9дёӘжңҲзҢҙйҮҚеӨҚз»ҷиҚҜжҜ’жҖ§иҜ•йӘҢпјҲ0.3гҖҒ1.5е’Ң6mg/kg/ж—ҘпјҢиҝһз»ӯз»ҷиҚҜ28еӨ©пјҢеҒңиҚҜ14еӨ©пјүдёӯпјҢ6mg/kg/ж—ҘеүӮйҮҸпјҲзәҰдёәRDDж—¶AUCзҡ„0.8еҖҚпјүж—¶йҷӨйҳҙйҒ“иҗҺзј©еӨ–пјҢиҝҳеҜ№еӯҗе®«е’ҢеҚөе·ўжңүеҪұе“ҚгҖӮ
еңЁйӣ„жҖ§з”ҹиӮІеҠӣиҜ•йӘҢдёӯпјҢйӣ„жҖ§еӨ§йј еңЁдёҺжңӘз»ҷиҚҜзҡ„йӣҢжҖ§еӨ§йј дәӨй…ҚеүҚпјҢз»ҸеҸЈз»ҷдәҲиҲ’е°јжӣҝе°ј1гҖҒ3жҲ–10mg/kg/ж—ҘпјҢиҝһз»ӯ58еӨ©гҖӮиҲ’е°јжӣҝе°јеүӮйҮҸвүӨ10mg/kg/ж—ҘпјҲзәҰдёә[RDDж—¶AUCзҡ„26еҖҚпјүж—¶пјҢеҜ№з”ҹиӮІиғҪеҠӣгҖҒдәӨй…ҚгҖҒеҸ—еӯ•жҢҮж•°е’ҢзІҫеӯҗжЈҖжҹҘпјҲеҪўжҖҒгҖҒзІҫеӯҗж•°е’Ңжҙ»еҠЁеәҰпјүжңӘи§ҒжҳҺжҳҫеҪұе“ҚгҖӮ
еңЁиғҡиғҺ-иғҺд»”еҸ‘иӮІжҜ’жҖ§иҜ•йӘҢдёӯпјҢеҰҠеЁ еӨ§йј е’ҢеҰҠеЁ е…”дәҺеҷЁе®ҳеҪўжҲҗжңҹз»ҸеҸЈз»ҷдәҲиҲ’е°јжӣҝе°јпјҢеүӮйҮҸеҲҶеҲ«дёә0.3гҖҒ1.5гҖҒ3гҖҒ5mg/kg/ж—Ҙе’Ң0.5гҖҒ1гҖҒ5гҖҒ20mg/kg/ж—ҘгҖӮеӨ§йј еңЁ5mg/kg/ж—ҘеүӮйҮҸж—¶пјҲзәҰдёәRDDж—¶AUCзҡ„5.5еҖҚпјүпјҢеҸҜи§ҒиғҡиғҺжӯ»дәЎеҸҠиӮӢйӘЁе’ҢжӨҺйӘЁз•ёеҪўгҖӮеӨ§йј еңЁвүӨ3mg/kg/ж—ҘеүӮйҮҸж—¶пјҲзәҰдёәRDDж—¶AUCзҡ„2еҖҚпјүпјҢеҜ№иғҺд»”жңӘи§ҒдёҚиүҜеҪұе“ҚгҖӮе…”еңЁ5mg/kg/ж—ҘеүӮйҮҸж—¶пјҲзәҰдёәRDDж—¶AUCзҡ„3еҖҚпјүеҸҜи§ҒиғҡиғҺжӯ»дәЎпјҢдё”еңЁвүҘ1mg/kg/ж—ҘеүӮйҮҸдёӢпјҲзәҰдёәRDDж—¶AUCзҡ„0.3еҖҚпјүеҸҜи§Ғе”ҮиЈӮе’Ңи…ӯиЈӮгҖӮ
еӨ§йј еӣҙдә§жңҹжҜ’жҖ§иҜ•йӘҢдёӯпјҢиҲ’е°јжӣҝе°јеүӮйҮҸдёә0.3гҖҒ1гҖҒ3mg/kg/ж—ҘгҖӮеңЁвүҘ1mg/kg/ж—ҘеүӮйҮҸпјҲзәҰдёәRDDж—¶AUCзҡ„0.5еҖҚпјүж—¶пјҢеӯ•жңҹе’Ңе“әд№іжңҹжҜҚдҪ“дҪ“йҮҚеўһй•ҝдёӢйҷҚгҖӮ3mg/kg/ж—ҘпјҲзәҰдёәRDDж—¶AUCзҡ„2еҖҚпјүж—¶пјҢеҸҜи§ҒйӣҢжҖ§е’Ңйӣ„жҖ§еӯҗд»ЈеҮәз”ҹиҮізҰ»д№іеүҚдҪ“йҮҚдёӢйҷҚпјҢйӣ„жҖ§еӯҗд»ЈзҰ»д№іеҗҺд»ҚеҸҜи§ҒдҪ“йҮҚдёӢйҷҚгҖӮеүӮйҮҸвүӨ1mg/kg/ж—Ҙж—¶пјҢжңӘи§ҒдёҚиүҜеҸ‘иӮІеҪұе“ҚгҖӮ
йӣҢжҖ§еӨ§йј з»ҷдәҲиҲ’е°јжӣҝе°ј15mg/kgпјҢиҲ’е°јжӣҝе°јеҸҠе…¶д»Ји°ўзү©д»Һд№іжұҒдёӯжіҢеҮәпјҢе…¶еңЁд№іжұҒдёӯзҡ„жө“еәҰй«ҳиҫҫиЎҖжөҶдёӯжө“еәҰзҡ„12еҖҚгҖӮ
з”ҹй•ҝжқҝејҖж”ҫзҡ„йЈҹиҹ№зҢҙз»ҷдәҲиҲ’е°јжӣҝе°јвүҘ3дёӘжңҲпјҲз»ҷиҚҜ3дёӘжңҲзҡ„еүӮйҮҸдёә2гҖҒ6гҖҒ12mg/kg/ж—Ҙпјӣз»ҷиҚҜ8дёӘе‘Ёжңҹзҡ„еүӮйҮҸдёә0.3гҖҒ1.5гҖҒ6.0mg/kg/ж—ҘпјүпјҢж №жҚ®зі»з»ҹжҡҙйңІпјҲAUCпјүжҺЁз®—пјҢеӨ§дәҺRDDж—¶зҡ„0.4еҖҚпјҢеҸҜи§ҒйӘЁйӘәеҸ‘иӮІдёҚиүҜгҖӮеҜ№еҸ‘иӮІжңҹеӨ§йј з»ҷдәҲиҲ’е°јжӣҝе°јиҝһз»ӯ3дёӘжңҲпјҲ1.5гҖҒ5.0е’Ң15.0mg/kgпјүжҲ–5дёӘе‘ЁжңҹпјҲ0.3гҖҒ1.5е’Ң6.0mg/kg/ж—ҘпјүпјҢеңЁеүӮйҮҸвүҘ5mg/kgпјҲзәҰдёәRDDзҡ„10еҖҚпјүж—¶пјҢеҸҜи§ҒйӘЁйӘјејӮеёёпјҢеҢ…жӢ¬иӮЎйӘЁзҡ„йӘәиҪҜйӘЁеўһеҺҡпјҢиғ«йӘЁйӘЁжҠҳеўһеҠ гҖӮжӯӨеӨ–пјҢеӨ§йј дёӯеңЁ>5mg/kgеүӮйҮҸж—¶еҸҜи§ҒйҫӢйҪҝеҸ‘з”ҹзҺҮеўһеҠ гҖӮйӘЁйӘәеҸ‘иӮІдёҚиүҜзҡ„еҸ‘з”ҹзҺҮе’ҢдёҘйҮҚзЁӢеәҰдёҺеүӮйҮҸзӣёе…іпјҢеҒңжӯўз»ҷиҚҜеҸҜжҒўеӨҚпјҢдҪҶзүҷйҪҝйҷӨеӨ–гҖӮзҢҙиҝһз»ӯз»ҷиҚҜ3дёӘжңҲиҜ•йӘҢжңӘи§ӮеҜҹеҲ°ж— жҜ’жҖ§ж•Ҳеә”еүӮйҮҸпјҢдҪҶй—ҙжӯҮз»ҷиҚҜ8е‘ЁжңҹиҜ•йӘҢзҡ„ж— жҜ’жҖ§ж•Ҳеә”еүӮйҮҸдёә1.5mg/kg/ж—ҘгҖӮеӨ§йј иҜ•йӘҢдёӯйӘЁйӘјзҡ„ж— жҜ’жҖ§ж•Ҳеә”еүӮйҮҸдёәвүӨ2mg/kg/ж—ҘгҖӮ
иҮҙзҷҢжҖ§пјҡ
еңЁrasH2иҪ¬еҹәеӣ е°Ҹйј е’ҢSDеӨ§йј дёӯиҝӣиЎҢдәҶиҮҙзҷҢжҖ§иҜ•йӘҢпјҢеҸҜи§Ғзӣёдјјзҡ„йҳіжҖ§з»“жһңгҖӮrasH2иҪ¬еҹәеӣ е°Ҹйј з»ҷдәҲиҲ’е°јжӣҝе°јиҝһз»ӯ1дёӘжңҲжҲ–6дёӘжңҲпјҢвүҘ25mg/kgеүӮйҮҸдёӢеҸҜи§ҒиғғеҚҒдәҢжҢҮиӮ зҷҢе’Ң/жҲ–иғғзІҳиҶңеўһз”ҹпјҢд»ҘеҸҠиЎҖз®ЎиӮүзҳӨеҸ‘з—…зҺҮеўһеҠ пјӣ8mg/kg/ж—ҘеүӮйҮҸдёӢжңӘи§Ғеўһз”ҹжҖ§ж”№еҸҳгҖӮ
еӨ§йј 2е№ҙиҮҙзҷҢиҜ•йӘҢдёӯпјҢз»ҷиҚҜ28еӨ©еҒңиҚҜ7еӨ©дёәдёҖе‘ЁжңҹйҮҚеӨҚпјҢеңЁеүӮйҮҸдҪҺиҮі1mg/kg/ж—ҘпјҲзәҰдёәRDDж—¶AUCзҡ„0.9еҖҚпјүж—¶еҸҜи§ҒеҚҒдәҢжҢҮиӮ зҷҢгҖӮй«ҳеүӮйҮҸ3mg/kg/ж—ҘпјҲзәҰдёәRDDж—¶AUCзҡ„7.8еҖҚпјүж—¶пјҢеҸҜи§ҒеҚҒдәҢжҢҮиӮ иӮҝзҳӨеҸ‘з”ҹзҺҮеўһеҠ пјҢ并дјҙжңүиғғзІҳиҶңз»Ҷиғһеўһз”ҹд»ҘеҸҠе—ң铬з»ҶиғһзҳӨе’ҢиӮҫдёҠи…әеўһз”ҹеҸ‘з”ҹзҺҮеўһеҠ гҖӮ
гҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘
е·ІеңЁ135дҫӢеҒҘеә·еҝ—ж„ҝиҖ…е’Ң266дҫӢе®һдҪ“зҳӨжӮЈиҖ…дёӯиҜ„д»·дәҶиҲ’е°јжӣҝе°је’ҢиӢ№жһңй…ёиҲ’е°јжӣҝе°јзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰгҖӮ
еҗёж”¶гҖҒеҲҶеёғгҖҒд»Ји°ўе’ҢжҺ’жі„
дёҖиҲ¬еңЁеҸЈжңҚз»ҷиҚҜеҗҺ6пҪһ12е°Ҹж—¶пјҲиҫҫеҲ°жңҖеӨ§иЎҖжөҶжө“еәҰзҡ„ж—¶й—ҙ[Tmax]пјүиҲ’е°јжӣҝе°јиҫҫеҲ°жңҖеӨ§иЎҖжөҶжө“еәҰпјҲCmaxпјүгҖӮиҝӣйЈҹеҜ№иҲ’е°јжӣҝе°јз”ҹзү©еҲ©з”ЁеәҰж— еҪұе“ҚгҖӮдёҺйЈҹзү©еҗҢжңҚжҲ–дёҚеҗҢжңҚеқҮеҸҜгҖӮ
дҪ“еӨ–е®һйӘҢиЎЁжҳҺиҲ’е°јжӣҝе°јеҸҠе…¶дё»иҰҒжҙ»жҖ§д»Ји°ўзү©зҡ„дәәиЎҖжөҶиӣӢзҷҪз»“еҗҲзҺҮеҲҶеҲ«дёә95%е’Ң90%пјҢеңЁ100пҪһ4000ng/mlиҢғеӣҙеҶ…ж— жө“еәҰдҫқиө–гҖӮиҲ’е°јжӣҝе°јзҡ„иЎЁи§ӮеҲҶеёғе®№з§ҜпјҲVd/Fпјүдёә2230LгҖӮеңЁ25пҪһ100mgзҡ„еүӮйҮҸиҢғеӣҙеҶ…пјҢиЎҖжөҶиҚҜж—¶жӣІзәҝдёӢйқўз§ҜпјҲAUCпјүе’ҢжңҖеӨ§иЎҖжөҶжө“еәҰпјҲCmaxпјүйҡҸеүӮйҮҸжҲҗжҜ”дҫӢеўһеҠ гҖӮ
иҲ’е°јжӣҝе°јдё»иҰҒз”ұз»ҶиғһиүІзҙ P450CYP3A4д»Ји°ўпјҢдә§з”ҹзҡ„дё»иҰҒжҙ»жҖ§д»Ји°ўзү©иў«CYP3A4иҝӣдёҖжӯҘд»Ји°ўгҖӮе…¶дё»иҰҒжҙ»жҖ§д»Ји°ўзү©еҚ жҖ»жҡҙйңІйҮҸзҡ„23пҪһ37%гҖӮдё»иҰҒйҖҡиҝҮзІӘдҫҝжҺ’жі„гҖӮеңЁдёҖйЎ№[14C]ж Үи®°зҡ„иҲ’е°јжӣҝе°јиҙЁйҮҸе№іиЎЎзҡ„дәәдҪ“иҜ•йӘҢдёӯпјҢеүӮйҮҸзҡ„61%жҳҜйҖҡиҝҮзІӘдҫҝжҺ’еҮәпјҢиҖҢиӮҫи„ҸжҺ’жі„зҡ„иҚҜзү©е’Ңд»Ји°ўзү©зәҰеҚ еүӮйҮҸзҡ„16%гҖӮиҲ’е°јжӣҝе°је’Ңдё»иҰҒжҙ»жҖ§д»Ји°ўзү©еңЁиЎҖжөҶгҖҒе°ҝе’ҢзІӘдҫҝдёӯеҸ‘зҺ°зҡ„дё»иҰҒиҚҜзү©зӣёе…іжҲҗеҲҶпјҢеҲҶеҲ«д»ЈиЎЁдәҶеҗҲ并ж Үжң¬дёӯзҡ„91.5%гҖҒ86.4%е’Ң73.8%зҡ„ж”ҫе°„жҙ»жҖ§гҖӮе°ҝе’ҢзІӘдҫҝдёӯиғҪжЈҖжөӢеҲ°ж¬ЎиҰҒд»Ји°ўзү©пјҢдҪҶеңЁиЎҖжөҶдёӯдёҖиҲ¬жңӘиғҪеҸ‘зҺ°гҖӮжҖ»еҸЈжңҚжё…йҷӨзҺҮпјҲCL/Fпјүдёә34пҪһ62еҚҮ/е°Ҹж—¶пјҢжӮЈиҖ…й—ҙзҡ„еҸҳејӮзі»ж•°дёә40%гҖӮ
еҒҘеә·еҝ—ж„ҝиҖ…еҸЈжңҚеҚ•еүӮйҮҸиҲ’е°јжӣҝе°јеҗҺпјҢиҲ’е°јжӣҝе°је’Ңдё»иҰҒжҙ»жҖ§д»Ји°ўзү©зҡ„з»Ҳжң«еҚҠиЎ°жңҹеҲҶеҲ«дёә40пҪһ60е°Ҹж—¶е’Ң80пҪһ110е°Ҹж—¶гҖӮжҜҸж—ҘйҮҚеӨҚз»ҷиҚҜеҗҺпјҢиҲ’е°јжӣҝе°ји“„з§Ҝ3пҪһ4еҖҚпјҢиҖҢе…¶дё»иҰҒд»Ји°ўзү©и“„з§Ҝ7пҪһ10еҖҚпјҢеңЁ10пҪһ14еӨ©еҶ…иҲ’е°јжӣҝе°је’Ңдё»иҰҒжҙ»жҖ§д»Ји°ўзү©иҫҫзЁіжҖҒжө“еәҰгҖӮ第14еӨ©иЎҖжөҶиҲ’е°јжӣҝе°је’Ңдё»иҰҒжҙ»жҖ§д»Ји°ўзү©зҡ„жҖ»жө“еәҰдёә62.9пҪһ101ng/mlгҖӮжҜҸж—ҘйҮҚеӨҚз»ҷиҚҜжҲ–жҢүжІ»з–—ж–№жЎҲйҮҚеӨҚе‘Ёжңҹз»ҷиҚҜпјҢжңӘеҸ‘зҺ°иҲ’е°јжӣҝе°је’Ңдё»иҰҒжҙ»жҖ§д»Ји°ўзү©зҡ„иҚҜд»ЈеҠЁеҠӣеӯҰжңүжҳҺжҳҫзҡ„еҸҳеҢ–гҖӮ
еҸ—иҜ•зҡ„еҒҘеә·еҝ—ж„ҝиҖ…е’Ңе®һдҪ“зҳӨжӮЈиҖ…зҡ„иҚҜд»ЈеҠЁеҠӣеӯҰзӣёдјјпјҢеҢ…жӢ¬иғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјүе’Ңжҷҡжңҹ/иҪ¬з§»жҖ§иӮҫз»ҶиғһзҷҢпјҲRCCпјүжӮЈиҖ…гҖӮ
дёҺеұһдәҺBCRPжҠ‘еҲ¶еүӮзҡ„иҚҜзү©еҗҲз”Ё
еңЁдҪ“еӨ–пјҢиҲ’е°јжӣҝе°јжҳҜеӨ–жҺ’еһӢиҪ¬иҝҗдҪ“BCRPзҡ„еә•зү©гҖӮеңЁз ”究A6181038дёӯпјҢдёҺBCRPжҠ‘еҲ¶еүӮеҗүйқһжӣҝе°јеҗҲз”ЁжІЎжңүеҜ№иҲ’е°јжӣҝе°јжҲ–жҖ»иҚҜзү©пјҲиҲ’е°јжӣҝе°ј+д»Ји°ўзү©пјүзҡ„Cmaxе’ҢAUCдә§з”ҹе…·жңүдёҙеәҠзӣёе…ізҡ„еҪұе“ҚпјҲи§ҒгҖҗиҚҜзү©зӣёдә’дҪңз”ЁгҖ‘пјүгҖӮиҜҘз ”з©¶жҳҜдёҖйЎ№еӨҡдёӯеҝғгҖҒејҖж”ҫжҖ§гҖҒв… /в…Ўжңҹз ”з©¶пјҢе…¶зӣ®зҡ„жҳҜеңЁMRCCжӮЈиҖ…дёӯиҜ„дј°иҲ’е°јжӣҝе°јдёҺеҗүйқһжӣҝе°јеҗҲз”Ёзҡ„е®үе…ЁжҖ§/иҖҗеҸ—жҖ§гҖҒжңҖеӨ§иҖҗеҸ—еүӮйҮҸе’ҢжҠ—иӮҝзҳӨжҙ»жҖ§гҖӮж¬ЎиҰҒз ”з©¶зӣ®зҡ„жҳҜиҜ„дј°еҗүйқһжӣҝе°јпјҲжҜҸеӨ©250 mgпјүе’ҢиҲ’е°јжӣҝе°јпјҲжҜҸеӨ©37.5 mg[йҳҹеҲ—1пјҢn=4]жҲ–50 mg[йҳҹеҲ—2пјҢn=7]пјҢжҢүз”ЁиҚҜ4е‘ЁеҶҚеҒңиҚҜ2е‘Ёзҡ„и®ЎеҲ’з»ҷиҚҜпјүеҗҲз”Ёж—¶дёӨиҖ…зҡ„иҚҜд»ЈеҠЁеҠӣеӯҰгҖӮиҲ’е°јжӣҝе°јиҚҜд»ЈеҠЁеҠӣеӯҰеҸӮж•°зҡ„ж”№еҸҳжІЎжңүдёҙеәҠж„Ҹд№үпјҢдё”жІЎжңүжҸҗзӨәд»»дҪ•иҚҜзү©й—ҙзӣёдә’дҪңз”ЁпјӣдҪҶиҖғиҷ‘еҲ°жӮЈиҖ…дәәж•°зӣёеҜ№иҫғе°‘пјҲеҚіN=7+4пјүпјҢдё”иҚҜд»ЈеҠЁеҠӣеӯҰеҸӮж•°зҡ„жӮЈиҖ…й—ҙеҸҳејӮжҖ§дёәдёӯеәҰиҮій«ҳеәҰпјҢйңҖи°Ёж…Һи§ЈиҜ»иҜҘз ”з©¶еҫ—еҮәзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰиҚҜзү©зӣёдә’дҪңз”ЁеҲҶжһҗз»“жһңгҖӮ
зү№ж®ҠзҫӨдҪ“
зҫӨдҪ“иҚҜд»ЈеҠЁеҠӣеӯҰеҲҶжһҗзҡ„дәәеҸЈеӯҰж•°жҚ®иЎЁжҳҺе№ҙйҫ„гҖҒдҪ“йҮҚгҖҒиӮҢй…җжё…йҷӨзҺҮгҖҒдәәз§ҚгҖҒжҖ§еҲ«жҲ–зҫҺеӣҪдёңйғЁиӮҝзҳӨеҚҸдҪңз»„пјҲECOGпјүдҪ“еҠӣзҠ¶жҖҒиҜ„еҲҶеҜ№иҲ’е°јжӣҝе°јжҲ–е…¶жҙ»жҖ§д»Ји°ўзү©зҡ„иҚҜд»ЈеҠЁеҠӣеӯҰжІЎжңүдёҙеәҠзӣёе…іжҖ§еҪұе“ҚгҖӮ
иӮқеҠҹиғҪдёҚе…Ё
Child-PughAзә§жҲ–Child-PughBзә§иӮқеҠҹиғҪжҚҹе®ізҡ„жӮЈиҖ…жҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—ж— йңҖи°ғж•ҙеҲқе§ӢеүӮйҮҸгҖӮиҲ’е°јжӣҝе°јеҸҠе…¶дё»иҰҒд»Ји°ўдә§зү©дё»иҰҒз”ұиӮқи„Ҹд»Ји°ўгҖӮдёҺиӮқеҠҹиғҪжӯЈеёёзҡ„жӮЈиҖ…зӣёжҜ”пјҢеҚ•еүӮиҲ’е°јжӣҝе°јеңЁиҪ»еәҰпјҲChild-PughAзә§пјүжҲ–дёӯеәҰпјҲChild-PughBзә§пјүиӮқеҠҹиғҪжҚҹе®ізҡ„жӮЈиҖ…дёӯзі»з»ҹжҡҙйңІйҮҸжҳҜзӣёдјјзҡ„гҖӮжңӘеңЁйҮҚеәҰпјҲChild-PughCзә§пјүиӮқеҠҹиғҪжҚҹе®іжӮЈиҖ…иҝӣиЎҢз ”з©¶гҖӮеңЁзҷҢз—ҮжӮЈиҖ…дёӯиҝӣиЎҢзҡ„дёҙеәҠз ”з©¶жҺ’йҷӨдәҶALTжҲ–AST>2.5еҖҚULNпјҢжҲ–еӣ иӮқиҪ¬з§»ALTжҲ–AST>5.0еҖҚULNзҡ„жӮЈиҖ…гҖӮ
иӮҫеҠҹиғҪдёҚе…Ё
дёҺиӮҫеҠҹиғҪжӯЈеёёпјҲCLcr>80ml/еҲҶй’ҹпјүзҡ„жӮЈиҖ…зӣёжҜ”пјҢеҚ•еүӮиҲ’е°јжӣҝе°јеңЁйҮҚеәҰиӮҫеҠҹиғҪжҚҹе®іпјҲCLcr<30ml/еҲҶй’ҹпјүзҡ„жӮЈиҖ…дёӯзі»з»ҹжҡҙйңІйҮҸжҳҜзӣёдјјзҡ„гҖӮ
иҪ»еәҰпјҲCLcr50-80mL/minпјүгҖҒдёӯеәҰпјҲCLcr30-<50mL/minпјүжҲ–йҮҚеәҰпјҲCLcr<30mL/minпјүиӮҫеҠҹиғҪжҚҹе®ідё”жңӘжҺҘеҸ—йҖҸжһҗзҡ„жӮЈиҖ…жҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—ж— йңҖи°ғж•ҙеҲқе§ӢеүӮйҮҸгҖӮеҗҺз»ӯеүӮйҮҸи°ғж•ҙеә”еҹәдәҺжӮЈиҖ…е®үе…ЁжҖ§еҸҠиҖҗеҸ—жҖ§и§ҒгҖҗеүӮйҮҸи°ғж•ҙгҖ‘гҖӮиЎҖж¶ІйҖҸжһҗзҡ„жң«жңҹиӮҫз—…жӮЈиҖ…пјҲESRDпјүж— йңҖи°ғж•ҙеҲқе§ӢеүӮйҮҸгҖӮиҲ’е°јжӣҝе°јеңЁиЎҖж¶ІйҖҸжһҗзҡ„жң«жңҹиӮҫз—…жӮЈиҖ…дёӯжҡҙйңІйҮҸжҜ”иӮҫеҠҹиғҪжӯЈеёёзҡ„жӮЈиҖ…дҪҺ47%гҖӮеӣ жӯӨпјҢеҗҺз»ӯеүӮйҮҸеҸҜиғҪйңҖж №жҚ®жӮЈиҖ…зҡ„е®үе…ЁжҖ§е’ҢиҖҗеҸ—жҖ§йҖҗжӯҘжҜ”еҲқе§ӢеүӮйҮҸеўһеҠ дёҖеҖҚгҖӮ
з§Қж—Ҹ
PKз ”з©¶RTKCпјҚ0511пјҚ009еңЁж–°еҠ еқЎиҝӣиЎҢпјҢжӮЈиҖ…дёә14дҫӢдәҡиЈ”пјҲеҢ…жӢ¬11дҫӢдёӯеӣҪдәәпјүе’Ң13дҫӢиҘҝж–№дәәзҡ„еҒҘеә·з”·жҖ§еҝ—ж„ҝиҖ…гҖӮиҲ’е°јжӣҝе°јеҚ•зӢ¬жҲ–иҖ…иҒ”еҗҲй…®еә·е”‘з»ҷиҚҜеҗҺпјҢдәҡжҙІдәәе№іеқҮзҡ„иҲ’е°јжӣҝе°је’Ңе…¶дё»иҰҒд»Ји°ўдә§зү©зҡ„жҡҙйңІпјҲCmaxгҖҒAUC0�lastе’ҢAUC0-пјүй«ҳдәҺиҘҝж–№дәәпјҢдҪҶжҳҜй…®еә·е”‘еҜ№дёӨз»„PKеҸӮж•°зҡ„еҪұе“ҚзЁӢеәҰзӣёдјјпјҢжҸҗзӨәдәҡжҙІдәәе’ҢиҘҝж–№дәәд»Ји°ўзӣёдјјгҖӮиҚҜзү©жҡҙйңІиҫғй«ҳдёҺдҪ“йҮҚжңүе…іпјҢеҜ№дҪ“йҮҚж ҮеҮҶеҢ–еҗҺзҡ„CLPOж•°еҖјиҝӣиЎҢжҜ”иҫғзҡ„з»“жһңиЎЁжҳҺпјҢеңЁеҗҢдёҖжІ»з–—жңҹй—ҙпјҢдёӨдёӘз§Қж—Ҹд№Ӣй—ҙе№іеқҮCLPOж•°еҖјжІЎжңүжҳҫи‘—жҖ§е·®ејӮпјҲиҲ’е°јжӣҝе°јеҚ•иҚҜжІ»з–—пјҢP=0.091пјӣиҒ”еҗҲй…®еә·е”‘жІ»з–—P=0.353пјүгҖӮ
гҖҗдёҚиүҜеҸҚеә”гҖ‘
з”ұдәҺеҗ„дёӘдёҙеәҠз ”з©¶зҡ„жғ…еҶөдёҚе°ҪзӣёеҗҢпјҢзӣҙжҺҘжҜ”иҫғдёӨз§ҚиҚҜзү©еңЁдёҚеҗҢдёҙеәҠз ”з©¶дёӯзҡ„дёҚиүҜеҸҚеә”еҸ‘з”ҹзҺҮжҳҜдёҚжҒ°еҪ“зҡ„пјҢдёҙеәҠз ”з©¶дёӯзҡ„дёҚиүҜеҸҚеә”еҸ‘з”ҹзҺҮд№ҹеҸҜиғҪдёҺдёҙеәҠе®һи·өдёӯзҡ„жғ…еҶөжңүжүҖдёҚеҗҢгҖӮ
ж”ҜжҢҒжң¬е“ҒдёҠеёӮзҡ„е…ій”®дёҙеәҠз ”з©¶зҡ„е®үе…ЁжҖ§ж•°жҚ®пјҡ
иғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјүгҖҒжҷҡжңҹиӮҫз»ҶиғһзҷҢпјҲRCCпјүжҲ–иғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјҲpNETпјүжӮЈиҖ…жңҖеёёи§Ғзҡ„дёҚиүҜеҸҚеә”пјҲвүҘ20%пјүжҳҜз–ІеҠігҖҒд№ҸеҠӣгҖҒеҸ‘зғӯгҖҒи…№жі»гҖҒжҒ¶еҝғгҖҒзІҳиҶңзӮҺ/еҸЈи…”зӮҺгҖҒе‘•еҗҗгҖҒж¶ҲеҢ–дёҚиүҜгҖҒи…№з—ӣгҖҒдҫҝз§ҳгҖҒй«ҳиЎҖеҺӢгҖҒеӨ–е‘Ёж°ҙиӮҝгҖҒзҡ®з–№гҖҒжүӢи¶із»јеҗҲеҫҒгҖҒзҡ®иӮӨиӨӘиүІгҖҒзҡ®иӮӨе№ІзҮҘгҖҒжҜӣеҸ‘йўңиүІж”№еҸҳгҖҒе‘іи§үж”№еҸҳгҖҒеӨҙз—ӣгҖҒиғҢз—ӣгҖҒе…іиҠӮз–јз—ӣгҖҒиӮўз«Ҝз–јз—ӣгҖҒе’іе—ҪгҖҒе‘јеҗёеӣ°йҡҫгҖҒеҺҢйЈҹе’ҢеҮәиЎҖгҖӮе…ідәҺжҪңеңЁдёҘйҮҚзҡ„дёҚиүҜеҸҚеә”пјҡиӮқжҜ’жҖ§гҖҒе·Ұеҝғе®ӨеҠҹиғҪйҡңзўҚгҖҒQTй—ҙжңҹ延й•ҝгҖҒеҮәиЎҖгҖҒй«ҳиЎҖеҺӢгҖҒз”ІзҠ¶и…әеҠҹиғҪдёҚе…ЁгҖҒиӮҫдёҠи…әеҠҹиғҪзҡ„и®Ёи®әи§ҒгҖҗжіЁж„ҸдәӢйЎ№гҖ‘гҖӮиғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјүгҖҒжҷҡжңҹиӮҫз»ҶиғһзҷҢпјҲRCCпјүе’Ңиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјҲpNETпјүз ”з©¶дёӯеҸ‘з”ҹзҡ„е…¶д»–дёҚиүҜеҸҚеә”еҰӮдёӢгҖӮ
дёӢеҲ—ж•°жҚ®жқҘиҮӘ660дҫӢжӮЈиҖ…пјҢе…¶дёӯиғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјүеҸҢзӣІгҖҒе®үж…°еүӮеҜ№з…§з ”究пјҲи§ҒгҖҗдёҙеәҠз ”з©¶гҖ‘пјүдёӯзҡ„жӮЈиҖ…жңү202дҫӢпјҢжҷҡжңҹиӮҫз»ҶиғһзҷҢпјҲRCCпјүйҳіжҖ§иҚҜзү©еҜ№з…§з ”究пјҲи§ҒгҖҗдёҙеәҠз ”з©¶гҖ‘пјүдёӯзҡ„жӮЈиҖ…жңү375дҫӢпјҢиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјҲpNETпјүе®үж…°еүӮеҜ№з…§з ”究пјҲи§ҒгҖҗдёҙеәҠз ”з©¶гҖ‘пјүдёӯзҡ„жӮЈиҖ…жңү83дҫӢгҖӮ
иғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјү
з ”з©¶1дёӯиҜ„д»·дәҶиҲ’е°јжӣҝе°јзҡ„е®үе…ЁжҖ§пјҢиҝҷжҳҜдёҖйЎ№йҡҸжңәгҖҒеҸҢзӣІгҖҒе®үж…°еүӮеҜ№з…§иҜ•йӘҢпјҢж—ўеҫҖжҺҘеҸ—иҝҮGISTжІ»з–—зҡ„жӮЈиҖ…жҜҸж—ҘжҢүз…§4/2з»ҷиҚҜж–№жЎҲжҺҘеҸ—иҲ’е°јжӣҝе°ј50mgпјҲn=202пјүжҲ–е®үж…°еүӮпјҲn=102пјүгҖӮ
еҸҢзӣІз ”究дёӯжӮЈиҖ…зҡ„дёӯдҪҚжІ»з–—жҢҒз»ӯж—¶й—ҙпјҢжҲӘиҮідёӯжңҹеҲҶжһҗиҲ’е°јжӣҝе°јз»„дёә2дёӘе‘ЁжңҹпјҲе№іеқҮдёә3.0дёӘе‘ЁжңҹпјҢиҢғеӣҙдёә1пҪһ9дёӘе‘ЁжңҹпјүпјҢе®үж…°еүӮз»„дёә1дёӘе‘ЁжңҹпјҲе№іеқҮдёә1.8дёӘе‘ЁжңҹпјҢиҢғеӣҙдёә1пҪһ6дёӘе‘ЁжңҹпјүгҖӮиҲ’е°јжӣҝе°јз»„23дҫӢпјҲ11%пјүжӮЈиҖ…еҸ‘з”ҹдәҶеүӮйҮҸеҮҸдҪҺпјҢе®үж…°еүӮз»„ж— жӮЈиҖ…еҸ‘з”ҹеүӮйҮҸеҮҸдҪҺгҖӮиҲ’е°јжӣҝе°јз»„е’Ңе®үж…°еүӮз»„еҲҶеҲ«жңү59дҫӢпјҲ29%пјүжӮЈиҖ…е’Ң31дҫӢпјҲ30%пјүжӮЈиҖ…еҸ‘з”ҹжІ»з–—дёӯж–ӯпјӣеҲҶеҲ«жңү7%е’Ң6%зҡ„жӮЈиҖ…еӣ жІ»з–—зӣёе…ізҡ„йқһиҮҙжӯ»жҖ§дёҚиүҜеҸҚеә”иҖҢеҜјиҮҙж°ёд№…жҖ§еҒңиҚҜгҖӮ
еңЁиҜ•йӘҢзҡ„еҸҢзӣІжІ»з–—жңҹпјҢдёӨдёӘз ”з©¶з»„жІ»з–—еҗҺеҮәзҺ°зҡ„еӨ§йғЁеҲҶдёҚиүҜеҸҚеә”дёҘйҮҚзЁӢеәҰдёә1зә§е’Ң2зә§гҖӮиҲ’е°јжӣҝе°јз»„е’Ңе®үж…°еүӮз»„жҠҘе‘Ҡзҡ„жІ»з–—еҗҺеҮәзҺ°зҡ„3зә§жҲ–4зә§дёҚиүҜеҸҚеә”еҸ‘з”ҹзҺҮеҲҶеҲ«дёә56%е’Ң51%гҖӮиЎЁ1жҜ”иҫғдәҶдёӨз»„жӮЈиҖ…жІ»з–—еҗҺеҮәзҺ°зҡ„еёёи§Ғзҡ„пјҲеҸ‘з”ҹзҺҮвүҘ10%пјүдёҚиүҜеҸҚеә”еҸ‘з”ҹзҺҮпјҢиҲ’е°јжӣҝе°јз»„зҡ„еҸ‘з”ҹзҺҮиҫғй«ҳгҖӮ
иЎЁ1.еңЁиҜ•йӘҢзҡ„еҸҢзӣІжІ»з–—жңҹпјҢз ”з©¶1дёӯиҲ’е°јжӣҝе°јз»„е’Ңе®үж…°еүӮз»„GISTжӮЈиҖ…жІ»з–—еҗҺеҮәзҺ°зҡ„дёҚиүҜеҸҚеә”еҲ—иЎЁпјҲеҸ‘з”ҹзҺҮвүҘ10%пјү*

*дёҚиүҜдәӢ件йҖҡз”ЁжңҜиҜӯж ҮеҮҶпјҲCTCAEпјүпјҢзүҲжң¬3.0гҖӮ
зј©з•ҘиҜҚпјҡGIST=иғғиӮ йҒ“й—ҙиҙЁзҳӨпјӣN=жӮЈиҖ…дәәж•°
aеҢ…жӢ¬йЈҹж¬ІдёӢйҷҚгҖӮ
еңЁиҜ•йӘҢзҡ„еҸҢзӣІжІ»з–—жңҹпјҢиҲ’е°јжӣҝе°јз»„е’Ңе®үж…°еүӮз»„еҲҶеҲ«жңү12дҫӢпјҲ6%пјүжӮЈиҖ…е’Ң3дҫӢпјҲ3%пјүжӮЈиҖ…еҸ‘з”ҹйқһзІҳиҶңзӮҺ/еҸЈи…”зӮҺжҖ§зҡ„еҸЈи…”з–јз—ӣпјӣеҲҶеҲ«жңү15дҫӢпјҲ7%пјүжӮЈиҖ…е’Ң4дҫӢпјҲ4%пјүжӮЈиҖ…еҸ‘з”ҹеҸ‘иүІж”№еҸҳпјӣеҲҶеҲ«жңү10дҫӢпјҲ5%пјүжӮЈиҖ…е’Ң2дҫӢпјҲ2%пјүжӮЈиҖ…еҸ‘з”ҹи„ұеҸ‘гҖӮ
иЎЁ2еҲ—еҮәдәҶеёёи§Ғзҡ„жІ»з–—еҗҺеҮәзҺ°зҡ„е®һйӘҢе®ӨжЈҖжҹҘејӮеёёпјҲеҸ‘з”ҹзҺҮвүҘ10%пјүгҖӮ
иЎЁ2.еңЁиҜ•йӘҢзҡ„еҸҢзӣІжІ»з–—жңҹпјҢз ”з©¶1дёӯиҲ’е°јжӣҝе°јз»„жҲ–е®үж…°еүӮз»„GISTжӮЈиҖ…еҮәзҺ°зҡ„е®һйӘҢе®ӨжЈҖжҹҘејӮеёёпјҲеҸ‘з”ҹзҺҮвүҘ10%пјү*

*дёҚиүҜдәӢ件йҖҡз”ЁжңҜиҜӯж ҮеҮҶпјҲCTCAEпјүпјҢзүҲжң¬3.0гҖӮ
зј©з•ҘиҜҚпјҡALT=дёҷж°Ёй…ёж°ЁеҹәиҪ¬з§»й…¶пјӣAST=еӨ©еҶ¬ж°Ёй…ёиҪ¬ж°Ёй…¶пјӣGIST=иғғиӮ йҒ“й—ҙиҙЁзҳӨпјӣLVEF=е·Ұе®Өе°„иЎҖеҲҶж•°пјӣN=жӮЈиҖ…дәәж•°гҖӮ
aиҲ’е°јжӣҝе°јз»„жӮЈиҖ…4зә§е®һйӘҢе®ӨжЈҖжҹҘејӮеёёеҢ…жӢ¬зўұжҖ§зЈ·й…ёй…¶пјҲ1%пјүпјҢи„ӮиӮӘй…¶пјҲ2%пјүпјҢиӮҢй…җпјҲ1%пјүпјҢиЎҖй’ҫдёӢйҷҚпјҲ1%пјүпјҢдёӯжҖ§зІ’з»ҶиғһпјҲ2%пјүпјҢиЎҖзәўиӣӢзҷҪпјҲ2%пјүе’ҢиЎҖе°ҸжқҝпјҲ1%пјүгҖӮ
bе®үж…°еүӮз»„жӮЈиҖ…4зә§е®һйӘҢе®ӨжЈҖжҹҘејӮеёёеҢ…жӢ¬ж·ҖзІүй…¶пјҲ1%пјүпјҢи„ӮиӮӘй…¶пјҲ1%пјүе’ҢиЎҖзәўиӣӢзҷҪпјҲ2%пјүгҖӮ
дёӯжңҹеҲҶжһҗеҗҺпјҢиҜҘиҜ•йӘҢжҸӯзӣІгҖӮе®үж…°еүӮз»„жӮЈиҖ…жңүжңәдјҡжҺҘеҸ—ејҖж”ҫзҡ„иҲ’е°јжӣҝе°јжІ»з–—пјҲеҸӮи§ҒгҖҗдёҙеәҠз ”з©¶гҖ‘пјүгҖӮеҜ№241дҫӢйҡҸжңәеҲҶиҮіиҲ’е°јжӣҝе°јз»„зҡ„жӮЈиҖ…пјҢеҢ…жӢ¬139дҫӢеҗҢж—¶еңЁеҸҢзӣІжңҹе’ҢејҖж”ҫжңҹйғҪжҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—пјҢиҲ’е°јжӣҝе°јдёӯдҪҚжІ»з–—ж—¶й—ҙдёә6дёӘе‘ЁжңҹпјҲе№іеқҮж•°8.5пјҢиҢғеӣҙ1пҪһ44пјүгҖӮеҜ№255дҫӢжңҖз»ҲжҺҘеҸ—ејҖж”ҫжңҹиҲ’е°јжӣҝе°јжІ»з–—зҡ„жӮЈиҖ…пјҢдёӯдҪҚжІ»з–—жңҹд»Һз»“жқҹеҸҢзӣІжңҹејҖе§Ӣи®Ўз®—дёә6дёӘе‘ЁжңҹпјҲе№іеқҮж•°7.8пјҢиҢғеӣҙ1пҪһ37пјүгҖӮе…ұжңү118дҫӢпјҲ46%пјүжӮЈиҖ…йңҖиҰҒдёӯж–ӯжІ»з–—пјҢ72дҫӢпјҲ28%пјүжӮЈиҖ…йңҖиҰҒеҮҸдҪҺеүӮйҮҸгҖӮ20%жӮЈиҖ…з”ұдәҺеҮәзҺ°жІ»з–—еҗҺдёҚиүҜеҸҚеә”д»ҺиҖҢж°ёд№…жҖ§еҒңиҚҜгҖӮејҖж”ҫжңҹжҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—жӮЈиҖ…жңҖеёёи§Ғзҡ„3жҲ–4зә§иҚҜзү©зӣёе…ідёҚиүҜеҸҚеә”дёәз–ІеҠіпјҲ10%пјүгҖҒй«ҳиЎҖеҺӢпјҲ8%пјүгҖҒд№ҸеҠӣпјҲ5%пјүгҖҒи…№жі»пјҲ5%пјүгҖҒжүӢи¶із»јеҗҲеҫҒпјҲ5%пјүгҖҒжҒ¶еҝғпјҲ4%пјүгҖҒи…№з—ӣпјҲ3%пјүгҖҒеҺҢйЈҹпјҲ3%пјүгҖҒзІҳиҶңзӮҺпјҲ2%пјүгҖҒе‘•еҗҗпјҲ2%пјүгҖҒз”ІзҠ¶и…әеҠҹиғҪеҮҸйҖҖпјҲ2%пјүгҖӮ
жҷҡжңҹиӮҫз»ҶиғһзҷҢпјҲRCCпјү
з ”з©¶3дёӯиҜ„д»·дәҶиҲ’е°јжӣҝе°јзҡ„е®үе…ЁжҖ§пјҢиҝҷжҳҜдёҖйЎ№еҸҢзӣІгҖҒжҙ»жҖ§еҜ№з…§иҜ•йӘҢпјҢжңүеұҖйғЁжҷҡжңҹжҲ–иҪ¬з§»жҖ§RCCзҡ„ж—ўеҫҖжңӘз»ҸжІ»з–—жӮЈиҖ…жҜҸж—ҘжҢүз…§4/2з»ҷиҚҜж–№жЎҲжҺҘеҸ—иҲ’е°јжӣҝе°ј50mgпјҲn=375пјүжҲ–IFN-Оұ9зҷҫдёҮеӣҪйҷ…еҚ•дҪҚпјҲMIUпјүпјҲn=360пјүгҖӮиҲ’е°јжӣҝе°јз»„е’ҢIFN-з»„зҡ„дёӯдҪҚжІ»з–—жҢҒз»ӯж—¶й—ҙеҲҶеҲ«жҳҜ11.1дёӘжңҲпјҲиҢғеӣҙпјҡ0.4пҪһ46.1дёӘжңҲпјүе’Ң4.1дёӘжңҲпјҲиҢғеӣҙпјҡ0.1пҪһ45.6дёӘжңҲпјүгҖӮиҲ’е°јжӣҝе°јз»„е’ҢIFN-з»„еҲҶеҲ«жңү202дҫӢпјҲ54%пјүе’Ң141дҫӢпјҲ39%пјүжӮЈиҖ…еҸ‘з”ҹжІ»з–—дёӯж–ӯгҖӮиҲ’е°јжӣҝе°јз»„е’ҢIFN-з»„еҲҶеҲ«жңү194дҫӢпјҲ52%пјүе’Ң98дҫӢпјҲ27%пјүжӮЈиҖ…йңҖиҰҒеҮҸдҪҺеүӮйҮҸгҖӮиҲ’е°јжӣҝе°јз»„е’ҢIFN-з»„еҲҶеҲ«жңү20%е’Ң23%зҡ„жӮЈиҖ…еӣ жІ»з–—еҗҺеҮәзҺ°зҡ„дёҚиүҜеҸҚеә”иҖҢеҜјиҮҙж°ёд№…жҖ§еҒңиҚҜгҖӮеӨ§йғЁеҲҶжІ»з–—еҗҺеҮәзҺ°зҡ„дёҚиүҜеҸҚеә”еқҮдёә1жҲ–2зә§гҖӮиҲ’е°јжӣҝе°јз»„е’ҢIFN-з»„жІ»з–—еҗҺеҲҶеҲ«жңү77%е’Ң55%зҡ„жӮЈиҖ…жҠҘе‘Ҡжңү3жҲ–4зә§зҡ„дёҚиүҜеҸҚеә”гҖӮиЎЁ3жҜ”иҫғдәҶиҲ’е°јжӣҝе°јз»„е’ҢIFN-з»„жІ»з–—еҗҺеёёи§Ғзҡ„пјҲвүҘ10%пјүдёҚиүҜеҸҚеә”гҖӮ
иЎЁ3.з ”з©¶3дёӯжҺҘеҸ—иҲ’е°јжӣҝе°јжҲ–IFN-жІ»з–—зҡ„RCCжӮЈиҖ…еҮәзҺ°зҡ„дёҚиүҜеҸҚеә”пјҲеҸ‘з”ҹзҺҮвүҘ10%пјү*

*дёҚиүҜдәӢ件йҖҡз”ЁжңҜиҜӯж ҮеҮҶпјҲCTCAEпјүпјҢзүҲжң¬3.0гҖӮ
зј©з•ҘиҜҚпјҡAR=дёҚиүҜдәӢ件пјӣIFN=е№Іжү°зҙ пјӣN=жӮЈиҖ…дәәж•°пјӣRCC=иӮҫз»ҶиғһзҷҢгҖӮ
aиҲ’е°јжӣҝе°јз»„4зә§дёҚиүҜеҸҚеә”еҢ…жӢ¬иғҢз—ӣпјҲ1%пјүпјҢе…іиҠӮз—ӣпјҲ<1%пјүпјҢе‘јеҗёеӣ°йҡҫпјҲ<1%пјүпјҢд№ҸеҠӣпјҲ<1%пјүпјҢз–ІеҠіпјҲ<1%пјүпјҢиӮўз—ӣпјҲ<1%пјүе’Ңзҡ®з–№пјҲ<1%пјүгҖӮ
bIFN-з»„4зә§дёҚиүҜеҸҚеә”еҢ…жӢ¬е‘јеҗёеӣ°йҡҫпјҲ1%пјүпјҢз–ІеҠіпјҲ1%пјүпјҢи…№з—ӣпјҲ1%пјүе’ҢжҠ‘йғҒпјҲ<1%пјүгҖӮ
cеҢ…жӢ¬и…°иӮӢз–јз—ӣгҖӮ
dеҢ…жӢ¬е‘іи§үдё§еӨұпјҢе‘іи§үеҮҸйҖҖе’Ңе‘іи§үйҡңзўҚгҖӮ
eеҢ…жӢ¬йЈҹж¬ІеҮҸйҖҖгҖӮ
fеҢ…жӢ¬1дҫӢ5зә§иғғеҮәиЎҖгҖӮ
gеҢ…жӢ¬жҠ‘йғҒжғ…з»ӘгҖӮ
иЎЁ4еҲ—еҮәдәҶжІ»з–—еҗҺеҮәзҺ°зҡ„3/4зә§е®һйӘҢе®ӨжЈҖжҹҘејӮеёёгҖӮ
иЎЁ4.з ”з©¶3дёӯжҺҘеҸ—иҲ’е°јжӣҝе°јжҲ–IFN-ОұжІ»з–—зҡ„еҲқжІ»RCCжӮЈиҖ…жІ»з–—еҗҺеҮәзҺ°зҡ„е®һйӘҢе®ӨжЈҖжҹҘејӮеёёпјҲеҸ‘з”ҹзҺҮвүҘ10%пјү

*дёҚиүҜдәӢ件йҖҡз”ЁжңҜиҜӯж ҮеҮҶпјҲCTCAEпјүпјҢзүҲжң¬3.0гҖӮ
зј©з•ҘиҜҚпјҡALT=дёҷж°Ёй…ёж°ЁеҹәиҪ¬з§»й…¶пјӣAST=еӨ©еҶ¬ж°Ёй…ёиҪ¬ж°Ёй…¶пјӣIFN=е№Іжү°зҙ пјӣN=жӮЈиҖ…дәәж•°пјӣRCC=иӮҫз»ҶиғһзҷҢгҖӮ
aиҲ’е°јжӣҝе°јз»„жӮЈиҖ…4зә§е®һйӘҢе®ӨжЈҖжҹҘејӮеёёеҢ…жӢ¬е°ҝй…ёпјҲ14%пјүпјҢи„ӮиӮӘй…¶пјҲ3%пјүпјҢдёӯжҖ§зІ’з»ҶиғһпјҲ2%пјүпјҢж·Ӣе·ҙз»ҶиғһпјҲ2%пјүпјҢиЎҖзәўиӣӢзҷҪпјҲ2%пјүпјҢиЎҖе°ҸжқҝпјҲ1%пјүпјҢж·ҖзІүй…¶пјҲ1%пјүпјҢALTпјҲ<1%пјүпјҢиӮҢй…ёжҝҖй…¶пјҲ<1%пјүпјҢиӮҢй…җпјҲ<1%пјүпјҢиЎҖзі–еҚҮй«ҳпјҲ<1%пјүпјҢиЎҖй’ҷдёӢйҷҚпјҲ<1%пјүпјҢиЎҖзЈ·пјҲ<1%пјүпјҢиЎҖй’ҫеҚҮй«ҳпјҲ<1%пјүе’ҢиЎҖй’ дёӢйҷҚпјҲ<1%пјүгҖӮ
bIFN-Оұз»„жӮЈиҖ…4зә§е®һйӘҢе®ӨжЈҖжҹҘејӮеёёеҢ…жӢ¬е°ҝй…ёпјҲ8%пјүпјҢж·Ӣе·ҙз»ҶиғһпјҲ2%пјүпјҢи„ӮиӮӘй…¶пјҲ1%пјүпјҢдёӯжҖ§зІ’з»ҶиғһпјҲ1%пјүпјҢж·ҖзІүй…¶пјҲ<1%пјүпјҢиЎҖй’ҷеҚҮй«ҳпјҲ<1%пјүпјҢиЎҖзі–дёӢйҷҚпјҲ<1%пјүпјҢиЎҖй’ҫеҚҮй«ҳпјҲ<1%пјүе’ҢиЎҖзәўиӣӢзҷҪпјҲ<1%пјүгҖӮ
иӮҫз»ҶиғһзҷҢжІ»з–—дёӯзҡ„й•ҝжңҹе®үе…ЁжҖ§
еҜ№еңЁиҙқдјҗзҸ еҚ•жҠ—е’Ңз»Ҷиғһеӣ еӯҗз–—ж•ҲдёҚдҪізҡ„дёҖзәҝжІ»з–—дёӯе®ҢжҲҗзҡ„9йЎ№дёҙеәҠз ”з©¶иҝӣиЎҢеҲҶжһҗпјҢд»ҘиҜ„дј°иҲ’е°јжӣҝе°јеңЁиҪ¬з§»жҖ§иӮҫз»ҶиғһзҷҢжӮЈиҖ…дёӯзҡ„й•ҝжңҹе®үе…ЁжҖ§гҖӮиҜҘеҲҶжһҗеҢ…еҗ«5739дҫӢжӮЈиҖ…пјҢе…¶дёӯ807дҫӢпјҲ14%пјүжҺҘеҸ—дәҶиҮіе°‘2е№ҙе’Ң365дҫӢпјҲ6%пјүжҺҘеҸ—дәҶиҮіе°‘3е№ҙзҡ„жІ»з–—гҖӮй•ҝжңҹдҪҝз”ЁиҲ’е°јжӣҝе°јдјјд№ҺдёҚдјҡеј•еҸ‘ж–°зҡ„жІ»з–—зӣёе…ідёҚиүҜеҸҚеә”зұ»еһӢгҖӮеңЁд№ӢеҗҺзҡ„ж—¶й—ҙзӮ№пјҢдёҚиүҜеҸҚеә”зҡ„е№ҙеҸ‘з”ҹзҺҮдјјд№ҺжІЎжңүеўһеҠ гҖӮ治疗第2е№ҙзҡ„з”ІзҠ¶и…әеҠҹиғҪеҮҸйҖҖеҸ‘з”ҹзҺҮеўһеҠ пјҢдё”й•ҝиҫҫ4е№ҙжңүж–°з—…дҫӢжҠҘе‘ҠгҖӮ
жҷҡжңҹиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјҲpNETпјү
еңЁз ”究6дёӯиҜ„д»·дәҶиҲ’е°јжӣҝе°јзҡ„е®үе…ЁжҖ§пјҢиҝҷжҳҜдёҖйЎ№йҡҸжңәгҖҒеҸҢзӣІгҖҒе®үж…°еүӮеҜ№з…§иҜ•йӘҢпјҢжңүиҝӣиЎҢжҖ§pNETзҡ„жӮЈиҖ…жҜҸж—ҘжҺҘеҸ—иҲ’е°јжӣҝе°ј37.5mgиҝһз»ӯз»ҷиҚҜпјҲn=83пјүжҲ–е®үж…°еүӮпјҲn=82пјүгҖӮиҲ’е°јжӣҝе°јз»„жІ»з–—дёӯдҪҚж—¶й—ҙдёә139еӨ©пјҲиҢғеӣҙ13пҪһ532еӨ©пјүпјҢе®үж…°еүӮз»„дёә113еӨ©пјҲиҢғеӣҙ1пҪһ614еӨ©пјүгҖӮиҲ’е°јжӣҝе°јз»„19дҫӢжӮЈиҖ…пјҲ23%пјүе’Ңе®үж…°еүӮз»„4дҫӢпјҲ5%пјүжӮЈиҖ…жҢҒз»ӯз”ЁиҚҜ>1е№ҙгҖӮ25дҫӢиҲ’е°јжӣҝе°јз»„жӮЈиҖ…пјҲ30%пјүе’Ң10дҫӢе®үж…°еүӮз»„жӮЈиҖ…пјҲ12%пјүеҸ‘з”ҹеҒңиҚҜгҖӮ26дҫӢпјҲ31%пјүиҲ’е°јжӣҝе°јз»„жӮЈиҖ…е’Ң9дҫӢпјҲ11%пјүе®үж…°еүӮз»„жӮЈиҖ…еҮҸдҪҺеүӮйҮҸгҖӮз”ұдәҺдёҚиүҜеҸҚеә”еј•иө·зҡ„еҒңиҚҜзҺҮеңЁиҲ’е°јжӣҝе°јз»„е’Ңе®үж…°еүӮз»„еҲҶеҲ«дёә22%е’Ң17%гҖӮ
дёӨдёӘжІ»з–—з»„дёӯзҡ„еӨ§еӨҡжІ»з–—зӣёе…ідёҚиүҜеҸҚеә”дёә1жҲ–2зә§гҖӮиҲ’е°јжӣҝе°јз»„е’Ңе®үж…°еүӮз»„еҲҶеҲ«жңү54%е’Ң50%зҡ„жӮЈиҖ…жҠҘе‘Ҡжңү3жҲ–4зә§зҡ„жІ»з–—зӣёе…ідёҚиүҜеҸҚеә”гҖӮиЎЁ5жҜ”иҫғдәҶиҲ’е°јжӣҝе°јжІ»з–—з»„дёӯеёёи§Ғзҡ„пјҲвүҘ10%пјүдё”зӣёеҜ№дәҺе®үж…°еүӮжІ»з–—з»„иҫғй«ҳзҡ„жІ»з–—зӣёе…ідёҚиүҜеҸҚеә”зҡ„еҸ‘з”ҹзҺҮгҖӮ
иЎЁ5.иҲ’е°јжӣҝе°јжІ»з–—иғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨзҡ„з ”з©¶6дёӯеёёи§ҒпјҲвүҘ10%пјүдё”иҫғй«ҳдәҺе®үж…°еүӮжІ»з–—з»„зҡ„дёҚиүҜеҸҚеә”зҡ„еҸ‘з”ҹзҺҮ*

*дёҚиүҜдәӢ件常用жңҜиҜӯж ҮеҮҶпјҲCTCAEпјүпјҢзүҲжң¬3.0гҖӮ
зј©з•ҘиҜҚпјҡN=жӮЈиҖ…дәәж•°пјӣpNET=иғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨгҖӮ
aиҲ’е°јжӣҝе°јз»„жӮЈиҖ…4зә§дёҚиүҜеҸҚеә”еҢ…жӢ¬з–ІеҠіпјҲ1%пјүгҖӮ
bеҢ…жӢ¬йҳҝеј—д»–жҖ§еҸЈи…”зӮҺпјҢзүҷйҫҲз–јз—ӣпјҢзүҷйҫҲзӮҺпјҢиҲҢзӮҺпјҢиҲҢз—ӣпјҢеҸЈи…”жәғз–ЎпјҢеҸЈи…”дёҚйҖӮпјҢеҸЈи…”з–јз—ӣпјҢиҲҢеӨҙжәғз–ЎпјҢзІҳиҶңе№ІзҮҘпјҢзІҳиҶңеҸ‘зӮҺпјҢеҸЈе№ІгҖӮ
cеҢ…жӢ¬и…№йғЁдёҚйҖӮгҖҒи…№йғЁз–јз—ӣе’ҢдёҠи…№з–јз—ӣгҖӮ
dеҢ…жӢ¬е‘•иЎҖпјҢдҫҝиЎҖпјҢиЎҖиӮҝпјҢе’іиЎҖпјҢеҮәиЎҖпјҢй»‘дҫҝе’Ңеӯҗе®«еҮәиЎҖгҖӮ
иЎЁ6жҸҗдҫӣдәҶеёёи§ҒпјҲвүҘ10%пјүзҡ„жІ»з–—зӣёе…іе®һйӘҢе®ӨжЈҖжҹҘејӮеёёж•°жҚ®гҖӮ
иЎЁ6.иҲ’е°јжӣҝе°јжІ»з–—иғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨзҡ„з ”з©¶6дёӯеёёи§ҒпјҲвүҘ10%пјүзҡ„е®һйӘҢе®ӨжЈҖжҹҘејӮеёё

*дёҚиүҜдәӢ件常и§ҒжңҜиҜӯж ҮеҮҶпјҲCTCAEпјүпјҢзүҲжң¬3.0гҖӮ
зј©з•ҘиҜҚпјҡALT=дёҷж°Ёй…ёж°ЁеҹәиҪ¬з§»й…¶пјӣAST=еӨ©еҶ¬ж°Ёй…ёиҪ¬ж°Ёй…¶пјӣN=жӮЈиҖ…дәәж•°пјӣpNET=иғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨгҖӮ
aиҲ’е°јжӣҝе°јжІ»з–—жӮЈиҖ…4зә§е®һйӘҢе®ӨжЈҖжҹҘејӮеёёеҢ…жӢ¬иӮҢй…җпјҲ4%пјүпјҢи„ӮиӮӘй…¶пјҲ4%пјүпјҢиЎҖзі–дёӢйҷҚпјҲ2%пјүпјҢиЎҖзі–еҚҮй«ҳпјҲ2%пјүпјҢдёӯжҖ§зІ’з»ҶиғһпјҲ2%пјүпјҢALTпјҲ1%пјүпјҢASTпјҲ1%пјүпјҢиЎҖе°ҸжқҝпјҲ1%пјүпјҢиЎҖй’ҫеҚҮй«ҳпјҲ1%пјүе’ҢжҖ»иғҶзәўзҙ пјҲ1%пјүгҖӮ
bе®үж…°еүӮжІ»з–—жӮЈиҖ…4зә§е®һйӘҢе®ӨжЈҖжҹҘејӮеёёеҢ…жӢ¬иӮҢй…җпјҲ3%пјүпјҢзўұжҖ§зЈ·й…ёй…¶пјҲ1%пјүпјҢиЎҖзі–еҚҮй«ҳпјҲ1%пјүе’Ңи„ӮиӮӘй…¶пјҲ1%пјүгҖӮ
дёӯеӣҪдәәзҫӨе®үе…ЁжҖ§ж•°жҚ®пјҡ
дёӯеӣҪиғғиӮ й—ҙиҙЁзҳӨжӮЈиҖ…з ”з©¶A6181177зҡ„е®үе…ЁжҖ§ж•°жҚ®
A6181177з ”з©¶жҳҜеңЁдёӯеӣҪејҖеұ•зҡ„дёҖйЎ№еҚ•иҮӮгҖҒејҖж”ҫгҖҒеӨҡдёӯеҝғгҖҒ4жңҹз ”з©¶пјҢдҪңдёәжү№еҮҶеҗҺжүҝиҜәз ”з©¶пјҢзӣ®зҡ„еңЁдәҺиҜ„дј°иӢ№жһңй…ёиҲ’е°јжӣҝе°јдҪңдёәдәҢзәҝжІ»з–—дёӯеӣҪз”ІзЈәй…ёдјҠ马жӣҝе°јжІ»з–—еҗҺз–ҫз—…иҝӣеұ•жҲ–еҜ№з”ІзЈәй…ёдјҠ马жӣҝе°јдёҚиҖҗеҸ—зҡ„дёӯеӣҪиғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјүжӮЈиҖ…зҡ„з–—ж•Ҳе’Ңе®үе…ЁжҖ§гҖӮжӮЈиҖ…жңҚз”ЁиӢ№жһңй…ёиҲ’е°јжӣҝе°јпјҢ50mgпјҢжҜҸж—ҘдёҖж¬ЎпјҢиҝһз”Ё4е‘ЁпјҢеҒңз”Ё2е‘ЁпјҲ4/2ж–№жЎҲпјүпјҢ6е‘ЁдёәдёҖдёӘжІ»з–—е‘ЁжңҹпјҢйҮҚеӨҚжІ»з–—гҖӮз ”з©¶зӯӣйҖүдәҶ62дҫӢжӮЈиҖ…пјҢ60дҫӢжӮЈиҖ…е…Ҙз»„жҺҘеҸ—жІ»з–—гҖӮ
еҸӮз…§з ”з©¶A6181004дёәиҲ’е°јжӣҝе°јGISTе…ЁзҗғжіЁеҶҢз ”з©¶пјҢдёә3жңҹгҖҒйҡҸжңәгҖҒеҸҢзӣІгҖҒе®үж…°еүӮеҜ№з…§з ”究пјҢжҜ”иҫғдәҶиҲ’е°јжӣҝе°јжІ»з–—з”ІзЈәй…ёдјҠ马жӣҝе°јиҖҗиҚҜжҲ–дёҚиғҪиҖҗеҸ—зҡ„жҒ¶жҖ§иғғиӮ й—ҙиҙЁзҳӨжӮЈиҖ…гҖӮиҜҘз ”з©¶еңЁзҫҺеӣҪпјҢжҫіеӨ§еҲ©дәҡпјҢж„ҸеӨ§еҲ©пјҢиӢұеӣҪпјҢжі•еӣҪпјҢж–°еҠ еқЎпјҢиҘҝзҸӯзүҷпјҢеҠ жӢҝеӨ§пјҢиҚ·е…°пјҢжҜ”еҲ©ж—¶е’Ңз‘һе…ёиҝӣиЎҢгҖӮ
иӢ№жһңй…ёиҲ’е°јжӣҝе°јеңЁеёёи§„ж ҮеҮҶжІ»з–—дёӯе…·жңүе®үе…ЁжҖ§е’ҢиүҜеҘҪзҡ„иҖҗеҸ—жҖ§гҖӮеёёи§Ғзҡ„жІ»з–—дёӯеҮәзҺ°зҡ„AEsпјҲвүҘ10%пјүеқҮдёәиҲ’е°јжӣҝе°јж—ўеҫҖжҠҘйҒ“иҝҮзҡ„дёҚиүҜдәӢ件пјҢеҢ…жӢ¬зҷҪз»ҶиғһеҮҸе°‘з—ҮгҖҒжүӢи¶із»јеҗҲеҫҒгҖҒз–Ід№ҸгҖҒдёӯжҖ§зІ’з»ҶиғһеҮҸе°‘з—ҮгҖҒиЎҖе°Ҹжқҝи®Ўж•°еҮҸе°‘гҖҒеӨ©еҶ¬ж°Ёй…ёж°ЁеҹәиҪ¬з§»й…¶еҚҮй«ҳгҖҒиЎҖзәўиӣӢзҷҪеҮҸе°‘гҖҒзҡ®иӮӨеҸҳиүІгҖҒй«ҳиЎҖеҺӢгҖӮе…¶дёӯеӨҡж•°дёҚиүҜдәӢ件зҡ„дёҘйҮҚзЁӢеәҰдёә1зә§жҲ–2зә§пјҢд№ҹжңүдёҖдәӣвүҘ3зә§зҡ„дёҚиүҜдәӢ件гҖӮз ”з©¶A6181177дёӯжІ»з–—зӣёе…ізҡ„дёҘйҮҚдёҚиүҜдәӢ件жҖ»еҸ‘з”ҹзҺҮиҫғдҪҺгҖӮз ”з©¶дёӯеҸ‘з”ҹзҺҮжңҖй«ҳзҡ„3з§ҚдёҚиүҜдәӢ件дёәзҷҪз»ҶиғһеҮҸе°‘з—ҮпјҲ64.4%пјүгҖҒз–Ід№ҸпјҲ52.5%пјүе’ҢжүӢи¶із»јеҗҲеҫҒпјҲ50.8%пјүгҖӮ
еҗҢеҸӮз…§з ”з©¶A6181004дёӯзҡ„жӮЈиҖ…жҜ”иҫғпјҢиҲ’е°јжӣҝе°јеңЁA6181177з ”з©¶дёӯеӣҪжӮЈиҖ…дёӯжҖ»зҡ„е®үе…ЁжҖ§жҳҜзӣёдјјзҡ„пјҢиҮід»Ҡж— йқһйў„жңҹзҡ„дёҚиүҜдәӢ件еҸ‘з”ҹгҖӮдёӨдёӘз ”з©¶е®үе…ЁжҖ§ж–№йқўзҡ„е·®ејӮдёәпјҡA6181177з ”з©¶зҡ„дёӯеӣҪжӮЈиҖ…жүӢи¶із»јеҗҲеҫҒгҖҒз–Ід№Ҹе’ҢдёҖдәӣиЎҖж¶ІеӯҰжҜ’жҖ§зҡ„еҸ‘з”ҹзҺҮз•Ҙй«ҳдәҺиҘҝж–№жӮЈиҖ…пјӣдёӯеӣҪжӮЈиҖ…зҡ„иғғиӮ йҒ“дёҚиүҜдәӢ件еҸ‘з”ҹзҺҮдҪҺдәҺиҘҝж–№жӮЈиҖ…гҖӮдёӨдёӘз ”з©¶зҡ„дё»иҰҒе®үе…ЁжҖ§з»“жһңжҖ»з»“дәҺдёӢиЎЁ7гҖӮ
жҖ»зҡ„жқҘиҜҙпјҢдёӨдёӘз ”з©¶дёӯжҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—зҡ„жӮЈиҖ…иҖҗеҸ—жҖ§иүҜеҘҪпјҢдёҚиүҜдәӢ件йҖҡиҝҮдёӯж–ӯз”ЁиҚҜгҖҒеҮҸйҮҸе’Ң/жҲ–ж ҮеҮҶжІ»з–—жҳҜеҸҜд»ҘжҺ§еҲ¶зҡ„гҖӮ
иЎЁ7.з ”з©¶A6181177дёӯеӣҪжӮЈиҖ…е’Ңз ”з©¶A6181004иҘҝж–№жӮЈиҖ…д№Ӣй—ҙжІ»з–—зӣёе…ідёҚиүҜдәӢ件зҡ„жҜ”иҫғ

дёӯеӣҪиӮҫз»ҶиғһзҷҢжӮЈиҖ…з ”з©¶A6181132зҡ„е®үе…ЁжҖ§ж•°жҚ®
A6181132з ”з©¶жҳҜеңЁдёӯеӣҪејҖеұ•зҡ„дёҖйЎ№еҚ•иҮӮгҖҒејҖж”ҫгҖҒеӨҡдёӯеҝғгҖҒ4жңҹз ”з©¶пјҢдҪңдёәжү№еҮҶеҗҺжүҝиҜәз ”з©¶пјҢзӣ®зҡ„еңЁдәҺиҜ„дј°иӢ№жһңй…ёиҲ’е°јжӣҝе°јдёҖзәҝжІ»з–—дёӯеӣҪиҪ¬з§»жҖ§иӮҫз»ҶиғһзҷҢжӮЈиҖ…зҡ„з–—ж•Ҳе’Ңе®үе…ЁжҖ§гҖӮжӮЈиҖ…жңҚз”ЁиӢ№жһңй…ёиҲ’е°јжӣҝе°јиғ¶еӣҠ50mgпјҢжҜҸж—ҘдёҖж¬ЎпјҢиҝһз”Ё4е‘ЁпјҢеҒңз”Ё2е‘ЁпјҲ4/2ж–№жЎҲпјүпјҢ6е‘ЁдёәдёҖдёӘжІ»з–—е‘ЁжңҹпјҢйҮҚеӨҚжІ»з–—гҖӮз ”з©¶е…Ҙз»„дәҶ105дҫӢжӮЈиҖ…гҖӮ
еҸӮз…§з ”з©¶A6181034жҳҜдёҖйЎ№йҡҸжңәгҖҒејҖж”ҫзҡ„3жңҹдёҙеәҠиҜ•йӘҢпјҢжҜ”иҫғдәҶиҲ’е°јжӣҝе°јдёҺОұ-е№Іжү°зҙ дҪңдёәиҪ¬з§»жҖ§иӮҫз»ҶиғһзҷҢзҡ„дёҖзәҝжІ»з–—зҡ„з–—ж•ҲгҖӮиҜҘз ”з©¶еңЁжҫіеӨ§еҲ©дәҡгҖҒе·ҙиҘҝгҖҒеҠ жӢҝеӨ§гҖҒжі•еӣҪгҖҒеҫ·еӣҪгҖҒж„ҸеӨ§еҲ©гҖҒжіўе…°гҖҒдҝ„зҪ—ж–ҜгҖҒзҫҺеӣҪгҖҒиӢұеӣҪе’ҢиҘҝзҸӯзүҷзҡ„з ”з©¶дёӯеҝғиҝӣиЎҢгҖӮ
A6181132з ”з©¶дёӯжңү98.1%зҡ„жӮЈиҖ…еҮәзҺ°жІ»з–—еҗҺеҮәзҺ°зҡ„дёҚиүҜдәӢ件гҖӮжңҖеёёи§Ғзҡ„дёҚиүҜдәӢ件пјҲиҮіе°‘20%жӮЈиҖ…еҮәзҺ°пјүжҖ»з»“дәҺиЎЁ8гҖӮжңҖеёёи§Ғзҡ„жІ»з–—еҗҺеҮәзҺ°зҡ„дёҚиүҜдәӢ件дёәжүӢи¶із»јеҗҲеҫҒгҖҒиЎҖе°Ҹжқҝи®Ўж•°еҮҸе°‘е’Ңз–Ід№ҸгҖӮ
еҗҢA6181034з ”з©¶дёӯзҡ„жӮЈиҖ…жҜ”иҫғпјҢиҲ’е°јжӣҝе°јеңЁA6181132з ”з©¶дёӯеӣҪжӮЈиҖ…дёӯжҖ»зҡ„е®үе…ЁжҖ§зү№еҫҒеҗҢеҸӮз…§з ”з©¶зӣёдјјпјҢиҮід»Ҡж— йқһйў„жңҹзҡ„дёҚиүҜдәӢ件еҸ‘з”ҹгҖӮжҖ»зҡ„жқҘиҜҙпјҢе®үе…ЁжҖ§з»“жһңеҗҢA6181034з ”з©¶е…·жңүеҸҜжҜ”жҖ§пјҢдҪҶд№ҹжңүдёҚеҗҢпјӣA6181132з ”з©¶дёӯзҡ„еҗҢжІ»з–—зӣёе…ізҡ„дёҘйҮҚдёҚиүҜдәӢ件еҸ‘з”ҹзҺҮиҫғдҪҺпјҢдёә12.4%пјҢA6181034з ”з©¶дёә23.7%гҖӮи…№жі»е’Ңз–Ід№ҸжҳҜеңЁдёӨдёӘз ”з©¶дёӯйғҪжҳҜиҫғеёёи§Ғзҡ„AEпјҢеҸ‘з”ҹзҺҮйғҪиҫғй«ҳгҖӮеңЁA6181132з ”з©¶дёӯеҸ‘з”ҹзҺҮдёәеүҚ3дҪҚзҡ„AEsеҲҶеҲ«жҳҜпјҡжүӢи¶із»јеҗҲеҫҒпјҲ63.8%пјүпјҢзҷҪз»Ҷиғһи®Ўж•°еҮҸе°‘пјҲ52.4%пјүе’Ңз–Ід№ҸпјҲ51.4%пјүгҖӮA6181034з ”з©¶дёӯеҸ‘з”ҹзҺҮдёәеүҚ3дҪҚзҡ„AEsеҲҶеҲ«жҳҜпјҡи…№жі»пјҲ65.6%пјүпјҢз–Ід№ҸпјҲ62.4%пјүе’ҢжҒ¶еҝғпјҲ57.6%пјүгҖӮ
жҖ»зҡ„жқҘиҜҙпјҢдёӨдёӘз ”з©¶дёӯжҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—зҡ„жӮЈиҖ…иҖҗеҸ—жҖ§иүҜеҘҪпјҢдёҚиүҜдәӢ件йҖҡиҝҮдёӯж–ӯз”ЁиҚҜгҖҒеҮҸйҮҸе’Ң/жҲ–ж ҮеҮҶжІ»з–—жҳҜеҸҜд»ҘжҺ§еҲ¶зҡ„гҖӮ
иЎЁ8.з ”з©¶A6181132дёӯеӣҪжӮЈиҖ…е’Ңз ”з©¶A6181034иҘҝж–№жӮЈиҖ…д№Ӣй—ҙжІ»з–—зӣёе…ідёҚиүҜдәӢ件зҡ„жҜ”иҫғ*
![яъi�ӯ|Ч]цЫMvгo�л_5У~6УOyзъiюҡҰ‘ҲI={ЯқГU=өЫҫ?Ұ”B�]чпmvлҺ¶Я}vФҒMлme·]щЧҸй§]yлmөЯmwЧҚwюҡQ<ҙҝҰ”O-)mХ�ЛKяй§ъiD Ҳ�ЮuЦ[uЧъiюҡҰҹй§ъiюҡҰҹй§яйҘЁky](http://www.360bzl.com/bzlteam_shopamdin/styles/plug/kingeditor/attached/image/20191003/20191003100700_92423.jpg) иӮҝзҳӨжә¶и§Јз»јеҗҲеҫҒ*пјҲиҜҰи§ҒгҖҗжіЁж„ҸдәӢйЎ№гҖ‘пјүгҖӮиЎҖзі–йҷҚдҪҺе·ІеңЁиҲ’е°јжӣҝе°јжІ»з–—дёӯжҠҘйҒ“пјҢеңЁжҹҗдәӣжғ…еҶөдёӢжңүдёҙеәҠз—ҮзҠ¶гҖӮ
иӮҝзҳӨжә¶и§Јз»јеҗҲеҫҒ*пјҲиҜҰи§ҒгҖҗжіЁж„ҸдәӢйЎ№гҖ‘пјүгҖӮиЎҖзі–йҷҚдҪҺе·ІеңЁиҲ’е°јжӣҝе°јжІ»з–—дёӯжҠҘйҒ“пјҢеңЁжҹҗдәӣжғ…еҶөдёӢжңүдёҙеәҠз—ҮзҠ¶гҖӮ
йӘЁйӘјиӮҢиӮүе’Ңз»“зј”з»„з»ҮејӮеёёпјҡзҳҳз®ЎеҪўжҲҗпјҢжңүж—¶дёҺиӮҝзҳӨеқҸжӯ»е’Ң/жҲ–ж¶ҲйҖҖ*зӣёе…іпјӣдёӢйўҢйӘЁеқҸжӯ»пјҲONJпјүпјҲиҜҰи§ҒгҖҗжіЁж„ҸдәӢйЎ№гҖ‘пјүпјӣиӮҢз—…е’Ң/жҲ–жЁӘзә№иӮҢжә¶и§Јз—ҮпјҢдјҙйҡҸжҲ–дёҚдјҙйҡҸжҖҘжҖ§иӮҫиЎ°*гҖӮеҸ‘зҺ°иӮҢдёӯжҜ’з—ҮзҠ¶жҲ–дҪ“еҫҒзҡ„жӮЈиҖ…пјҢеә”жҺҘеҸ—иҚҜзү©жІ»з–—гҖӮ
иӮҫи„Ҹе’ҢжіҢе°ҝзі»з»ҹејӮеёёпјҡиӮҫеҠҹиғҪжҚҹдјӨе’Ң/жҲ–иӮҫиЎ°*пјӣиӣӢзҷҪе°ҝпјӣе°‘ж•°иӮҫз—…з»јеҗҲеҫҒгҖӮжҺЁиҚҗиҝӣиЎҢеҹәзәҝе°ҝеҲҶжһҗпјҢзӣ‘жҺ§жӮЈиҖ…иӣӢзҷҪе°ҝеҮәзҺ°жҲ–еҠ йҮҚгҖӮеҜ№дёӯеәҰеҲ°йҮҚеәҰиӣӢзҷҪе°ҝжӮЈиҖ…жҢҒз»ӯиҲ’е°јжӣҝе°јжІ»з–—зҡ„е®үе…ЁжҖ§пјҢе°ҡжңӘзі»з»ҹиҜ„дј°гҖӮеҜ№иӮҫз—…з»јеҗҲеҫҒжӮЈиҖ…пјҢз»ҲжӯўиҲ’е°јжӣҝе°јжІ»з–—гҖӮ
е‘јеҗёзі»з»ҹејӮеёёпјҡиӮәж “еЎһ*пјҲиҜҰи§ҒгҖҗжіЁж„ҸдәӢйЎ№гҖ‘пјүгҖӮ
зҡ®иӮӨе’Ңзҡ®дёӢз»„з»ҮејӮеёёпјҡеқҸз–ҪжҖ§и„“зҡ®з—…пјҢеҢ…еҗ«еҺ»жҝҖеҸ‘йҳіжҖ§пјӣеӨҡеҪўжҖ§зәўж–‘е’ҢStevens-Johnsonз»јеҗҲеҫҒпјҲSJSпјү-зҪ•и§ҒгҖӮ
иЎҖз®ЎејӮеёёпјҡеҠЁи„үиЎҖж “ж “еЎһдәӢ件*гҖӮжңҖеёёи§Ғзҡ„дәӢ件еҢ…жӢ¬и„‘иЎҖз®Ўж„ҸеӨ–гҖҒзҹӯжҡӮжҖ§и„‘зјәиЎҖеҸ‘дҪңеҸҠи„‘жў—гҖӮйҷӨдәҶжҪңеңЁзҡ„жҒ¶жҖ§з—…е’Ңе№ҙйҫ„65еІҒд»ҘеӨ–пјҢдёҺеҠЁи„үиЎҖж “ж “еЎһдәӢ件зӣёе…ізҡ„йЈҺйҷ©еӣ зҙ иҝҳеҢ…жӢ¬й«ҳиЎҖеҺӢгҖҒзі–е°ҝз—…е’Ңж—ўеҫҖиЎҖж “ж “еЎһз—…гҖӮ
еҮәиЎҖдәӢ件пјҡиӮәгҖҒиғғиӮ йҒ“гҖҒиӮҝзҳӨгҖҒжіҢе°ҝйҒ“е’Ңи„‘еҮәиЎҖгҖӮ
зҘһз»Ҹзі»з»ҹејӮеёёпјҡе‘іи§үејӮеёёпјҢеҢ…жӢ¬е‘іи§үдё§еӨұгҖӮ
еҶ…еҲҶжіҢејӮеёёпјҡдёҙеәҠз ”з©¶еҸҠдёҠеёӮеҗҺз”ЁиҚҜжӣҫжҠҘе‘ҠзҪ•и§Ғз”ІзҠ¶и…әеҠҹиғҪдәўиҝӣпјҢйғЁеҲҶйҡҸеҗҺеҮәзҺ°з”ІзҠ¶и…әеҠҹиғҪеҮҸйҖҖпјӣз”ІзҠ¶и…әзӮҺ-е°‘и§ҒгҖӮ
еҝғи„ҸејӮеёёпјҡеҝғиӮҢз—…*гҖҒеҝғиӮҢзјәиЎҖa*гҖҒеҝғиӮҢжў—жӯ»b*гҖӮ
иғғиӮ йҒ“ејӮеёёпјҡйЈҹз®ЎзӮҺ-еёёи§ҒгҖӮ
*еҢ…еҗ«дёҖдәӣиҮҙжӯ»жҖ§гҖӮ
aжҖҘжҖ§еҶ зҠ¶еҠЁи„үз»јеҗҲеҫҒгҖҒеҝғз»һз—ӣгҖҒдёҚзЁіе®ҡеҝғз»һз—ӣпјҢеҶ зҠ¶еҠЁи„үйҳ»еЎһпјҢеҝғиӮҢзјәиЎҖгҖӮ
bжҖҘжҖ§еҝғиӮҢжў—жӯ»гҖҒеҝғиӮҢжў—жӯ»гҖҒж— з—ҮзҠ¶жҖ§еҝғиӮҢжў—жӯ»гҖӮ
е„ҝз«ҘжӮЈиҖ…
е·ІеңЁ35дҫӢжӮЈжңүйҡҫжІ»жҖ§е®һдҪ“зҳӨзҡ„е„ҝз«Ҙе’Ңйқ’е№ҙжӮЈиҖ…пјҲ2-21еІҒпјүдёӯиҝӣиЎҢдәҶдёҖйЎ№еҸЈжңҚиҲ’е°јжӣҝе°јзҡ„1жңҹеүӮйҮҸйҖ’еўһз ”з©¶пјҢе…Ҙз»„зҡ„еӨ§еӨҡж•°жӮЈиҖ…зҡ„еҲқжӯҘиҜҠж–ӯдёәи„‘иӮҝзҳӨгҖӮжүҖжңүз ”з©¶еҸӮдёҺиҖ…йғҪеҮәзҺ°иҚҜзү©дёҚиүҜеҸҚеә”пјҢдё”еңЁж—ўеҫҖжҡҙйңІдәҺи’ҪзҺҜзұ»иҚҜзү©жҲ–еҝғи„Ҹиҫҗе°„зҡ„жӮЈиҖ…дёӯпјҢеӨ§еӨҡж•°дёәдёҘйҮҚдёҚиүҜеҸҚеә”пјҲжҜ’жҖ§зӯүзә§вүҘ3пјүпјҢ并еҢ…еҗ«еҝғи„ҸжҜ’жҖ§гҖӮдёҺж—ўеҫҖжңӘжҡҙйңІдәҺеҝғи„Ҹиҫҗе°„е’Ңи’ҪзҺҜзұ»иҚҜзү©зҡ„е„ҝз«ҘжӮЈиҖ…зӣёжҜ”пјҢж—ўеҫҖеҸ‘з”ҹжҡҙйңІзҡ„е„ҝз«ҘжӮЈиҖ…еҮәзҺ°еҝғи„ҸиҚҜзү©дёҚиүҜеҸҚеә”зҡ„йЈҺйҷ©жӣҙй«ҳгҖӮз”ұдәҺеҮәзҺ°еүӮйҮҸйҷҗеҲ¶жҖ§жҜ’жҖ§пјҢеӣ жӯӨиҜҘжӮЈиҖ…дәәзҫӨзҡ„иҲ’е°јжӣҝе°јжңҖеӨ§иҖҗеҸ—еүӮйҮҸе°ҡжңӘзЎ®е®ҡгҖӮеңЁж—ўеҫҖжңӘжҡҙйңІдәҺи’ҪзҺҜзұ»иҚҜзү©жҲ–еҝғи„Ҹиҫҗе°„зҡ„е„ҝз«ҘжӮЈиҖ…дёӯпјҢжңҖеёёи§Ғзҡ„дёҚиүҜеҸҚеә”дёәиғғиӮ йҒ“жҜ’жҖ§гҖҒдёӯжҖ§зІ’з»ҶиғһеҮҸе°‘гҖҒз–ІеҠіе’ҢALTеҚҮй«ҳгҖӮ
ж №жҚ®дёҖйЎ№зҫӨдҪ“иҚҜд»ЈеҠЁеҠӣеӯҰпјҲPKпјүе’ҢиҚҜд»ЈеҠЁеҠӣеӯҰ/иҚҜж•ҲеӯҰпјҲPK/PDпјүеҲҶжһҗпјҢдёҺжҺҘеҸ—50 mg/еӨ©пјҲ4/2з»ҷиҚҜж–№жЎҲпјүжІ»з–—зҡ„иғғиӮ йҒ“й—ҙиҙЁзҳӨжҲҗдәәжӮЈиҖ…зӣёжҜ”пјҢеүӮйҮҸдёә25 mg/m2/еӨ©пјҲ4/2з»ҷиҚҜж–№жЎҲпјүзҡ„иҲ’е°јжӣҝе°јйў„и®ЎеңЁиғғиӮ йҒ“й—ҙиҙЁзҳӨе„ҝз«ҘжӮЈиҖ…пјҲ6-11е’Ң12�17еІҒпјүдёӯзҡ„жң¬е“ҒиЎҖжөҶжҡҙйңІйҮҸзӣёеҪ“пјҢдё”йҡҸеҗҺзҡ„е®үе…ЁжҖ§е’Ңз–—ж•Ҳд№ҹзӣёеҪ“гҖӮ
гҖҗжіЁж„ҸдәӢйЎ№гҖ‘
е»әи®®еңЁжңүжң¬е“ҒдҪҝз”Ёз»ҸйӘҢзҡ„еҢ»з”ҹжҢҮеҜјдёӢдҪҝз”ЁгҖӮ
зҡ®иӮӨе’Ңз»„з»Ү
зҡ®иӮӨйҖҖиүІжҳҜеңЁдёҙеәҠиҜ•йӘҢдёӯжҠҘе‘Ҡзҡ„дёҖз§ҚеҫҲеёёи§Ғзҡ„дёҚиүҜеҸҚеә”пјҢеҸҜиғҪеӣ жҙ»жҖ§зү©иҙЁзҡ„йўңиүІпјҲй»„иүІпјүйҖ жҲҗгҖӮеә”е‘ҠзҹҘжӮЈиҖ…пјҢдҪҝз”ЁиҲ’е°јжӣҝе°јжІ»з–—жңҹй—ҙиҝҳеҸҜиғҪеҮәзҺ°еӨҙеҸ‘жҲ–зҡ®иӮӨи„ұиүІгҖӮе…¶д»–еҸҜиғҪзҡ„зҡ®иӮӨеҪұе“ҚеҢ…жӢ¬зҡ®иӮӨе№ІзҮҘгҖҒеҸҳеҺҡжҲ–ејҖиЈӮд»ҘеҸҠжүӢжҺҢе’Ңи„ҡеә•жқҝеҮәзҺ°ж°ҙжіЎжҲ–еҒ¶и§Ғзҡ®з–№гҖӮ
дёҠиҝ°дёҚиүҜдәӢ件没жңүзҙҜз§Ҝж•Ҳеә”пјҢдёҖиҲ¬жғ…еҶөдёӢеҸҜйҖҶпјҢйҖҡеёёдёҚдјҡеҜјиҮҙжІ»з–—з»ҲжӯўгҖӮ
йңҖиҰҒиӯҰжғ•йӮЈдәӣеҸҜеҜјиҮҙжӯ»дәЎзҡ„зҪ•и§ҒдёҘйҮҚзҡ®иӮӨеҸҚеә”пјҢе·ІжҠҘйҒ“з—…дҫӢеҢ…жӢ¬еӨҡеҪўжҖ§зәўж–‘пјҲEMпјүгҖҒз–‘дјјStevens-Johnsonз»јеҗҲеҫҒпјҲSJSпјүе’ҢдёӯжҜ’жҖ§иЎЁзҡ®еқҸжӯ»жқҫи§Јз—ҮпјҲTENпјүгҖӮиӢҘеҮәзҺ°з–‘дјјEMпјҢSJSжҲ–TENзҡ„з—ҮзҠ¶жҲ–дҪ“еҫҒпјҲеҰӮжёҗиҝӣжҖ§еҠ йҮҚзҡ„зҡ®з–№пјҢеёёеҗҲ并еҮәзҺ°ж°ҙжіЎжҲ–й»ҸиҶңжҚҹдјӨпјүпјҢеә”жҡӮеҒңиҲ’е°јжӣҝе°јжІ»з–—гҖӮеҰӮжһңзЎ®иҜҠSJSжҲ–TENпјҢе°ұеҝ…йЎ»з»ҲжӯўиҲ’е°јжӣҝе°јгҖӮз–‘дјјEMзҡ„з—…дҫӢдёӯпјҢеңЁзҡ®иӮӨз—ҮзҠ¶ж¶ҲйҖҖеҗҺпјҢйғЁеҲҶжӮЈиҖ…еҸҜиҖҗеҸ—еҶҚж¬ЎејҖе§Ӣзҡ„иҫғдҪҺеүӮйҮҸзҡ„иҲ’е°јжӣҝе°јжІ»з–—пјӣйғЁеҲҶжӮЈиҖ…еҸҜжҺҘеҸ—иҲ’е°јжӣҝе°јдёҺзҡ®иҙЁзұ»еӣәйҶҮжҝҖзҙ жҲ–жҠ—з»„иғәиҚҜзҡ„иҒ”еҗҲжІ»з–—гҖӮ
иӮқжҜ’жҖ§
жң¬е“ҒеҸҜеј•иө·йҮҚеәҰиӮқжҜ’жҖ§пјҢд»ҺиҖҢеҜјиҮҙиӮқи„ҸеҠҹиғҪиЎ°з«ӯжҲ–жӯ»дәЎгҖӮе·ІеңЁдёҙеәҠз ”з©¶дёӯи§ӮеҜҹеҲ°иӮқи„ҸиЎ°з«ӯзҡ„еҸ‘з”ҹпјҲеҸ‘з”ҹзҺҮ<1%пјүгҖӮиӮқи„ҸиЎ°з«ӯзҡ„иЎЁзҺ°еҢ…жӢ¬й»„з–ёгҖҒж°ЁеҹәиҪ¬з§»й…¶еҚҮй«ҳгҖҒе’Ң/жҲ–й«ҳиғҶзәўзҙ иЎҖз—ҮдјҙйҡҸи„‘йғЁз–ҫз—…гҖҒеҮқиЎҖгҖҒе’Ң/жҲ–иӮҫеҠҹиғҪиЎ°з«ӯгҖӮеңЁжІ»з–—ејҖе§ӢеүҚгҖҒжҜҸдёӘжІ»з–—е‘ЁжңҹгҖҒд»ҘеҸҠдёҙеәҠйңҖиҰҒж—¶еә”зӣ‘жөӢиӮқеҠҹиғҪпјҲдёҷж°Ёй…ёж°ЁеҹәиҪ¬з§»й…¶[ALT]пјҢеӨ©еҶ¬ж°Ёй…ёиҪ¬ж°Ёй…¶[AST]пјҢиғҶзәўзҙ пјүгҖӮеҪ“еҮәзҺ°3зә§жҲ–4зә§иҚҜзү©зӣёе…ізҡ„иӮқеҠҹиғҪдёҚиүҜеҸҚеә”ж—¶еә”дёӯж–ӯз”ЁиҚҜпјҢиӢҘж— жі•жҒўеӨҚеә”з»ҲжӯўжІ»з–—гҖӮеҪ“жӮЈиҖ…еңЁйҡҸеҗҺзҡ„иӮқеҠҹиғҪеҢ–йӘҢдёӯжҳҫзӨәдёҘйҮҚзҡ„иӮқеҠҹиғҪжЈҖжҹҘејӮеёёпјҢжҲ–еҮәзҺ°е…¶д»–зҡ„иӮқеҠҹиғҪиЎ°з«ӯеҫҒзҠ¶ж—¶пјҢдёҚеҸҜйҮҚж–°ејҖе§Ӣз»ҷиҚҜжІ»з–—гҖӮ
еҜ№дәҺжң¬е“ҒеңЁALTжҲ–AST>2.5еҖҚжӯЈеёёдёҠйҷҗеҖјпјҲULNпјүжҲ–жҳҜж°ЁеҹәиҪ¬з§»й…¶>5.0еҖҚULNзҡ„жӮЈиҖ…дёӯзҡ„е®үе…ЁжҖ§жңӘз»ҸзЎ®и®ӨгҖӮ
еҝғиЎҖз®ЎдәӢ件
иӢҘеҮәзҺ°е……иЎҖжҖ§еҝғеҠӣиЎ°з«ӯпјҲCHFпјүзҡ„дёҙеәҠиЎЁзҺ°пјҢеә”еҒңжӯўдҪҝз”Ёжң¬е“ҒгҖӮ
иӢҘеҮәзҺ°е……иЎҖжҖ§еҝғеҠӣиЎ°з«ӯпјҲCHFпјүзҡ„дёҙеәҠиЎЁзҺ°пјҢеҲҷжҡӮеҒңдҪҝз”Ёжң¬е“ҒгҖӮж— е……иЎҖжҖ§еҝғеҠӣиЎ°з«ӯдёҙеәҠиҜҒжҚ®дҪҶе°„иЎҖеҲҶж•°>20%дё”<50%еҹәзәҝеҖјжҲ–иҖ…дҪҺдәҺжӯЈеёёдёӢйҷҗпјҲеҰӮжһңжңӘиҺ·еҫ—еҹәзәҝе°„иЎҖеҲҶж•°пјүзҡ„жӮЈиҖ…д№ҹеә”дёӯж–ӯжң¬е“ҒжІ»з–—е’Ң/жҲ–еҮҸдҪҺеүӮйҮҸгҖӮ
еңЁжІЎжңүеҝғи„ҸйЈҺйҷ©еӣ зҙ зҡ„жӮЈиҖ…дёӯпјҢеә”иҖғиҷ‘иҜ„дј°еҹәзәҝе°„иЎҖеҲҶж•°гҖӮжӯӨзұ»жӮЈиҖ…жҺҘеҸ—жң¬е“ҒжІ»з–—ж—¶пјҢеә”д»”з»Ҷзӣ‘жөӢе…¶CHFзҡ„дёҙеәҠз—ҮзҠ¶е’ҢдҪ“еҫҒпјҢд№ҹеә”иҖғиҷ‘иҝӣиЎҢеҹәзәҝе’Ңе®ҡжңҹе·Ұеҝғе®Өе°„иЎҖеҲҶж•°пјҲLVEFпјүиҜ„дј°гҖӮ
дёҠеёӮеҗҺжӣҫжҠҘе‘ҠеҝғиЎҖз®ЎдәӢ件пјҢеҢ…жӢ¬еҝғиЎ°гҖҒеҝғиӮҢз—…гҖҒеҝғиӮҢзјәиЎҖе’ҢеҝғиӮҢжў—жӯ»пјҢйғЁеҲҶдёәиҮҙжӯ»жҖ§гҖӮ
жҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—зҡ„иғғиӮ й—ҙиҙЁзҳӨе’ҢиӮҫз»ҶиғһзҷҢжӮЈиҖ…дёӯеҮәзҺ°е·Ұеҝғе®Өе°„иЎҖеҲҶж•°дёӢйҷҚзҡ„дәәж•°еӨҡдәҺе®үж…°еүӮз»„жҲ–IFN-Оұз»„гҖӮеңЁиғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјүзҡ„з ”з©¶1зҡ„еҸҢзӣІжңҹпјҢиҲ’е°јжӣҝе°јз»„е’Ңе®үж…°еүӮз»„еҲҶеҲ«жңү22/209дҫӢпјҲ11%пјүжӮЈиҖ…е’Ң3/102дҫӢпјҲ3%пјүжӮЈиҖ…еҮәзҺ°дәҶжІ»з–—зӣёе…ізҡ„е·Ұеҝғе®Өе°„иЎҖеҲҶж•°пјҲLVEFпјүдҪҺдәҺжӯЈеёёеҖјдёӢйҷҗпјҲLLNпјүгҖӮиҲ’е°јжӣҝе°јз»„22дҫӢLVEFж”№еҸҳзҡ„жӮЈиҖ…дёӯжңү9дҫӢжңӘз»ҸеӨ„зҗҶиҮӘиЎҢжҒўеӨҚпјӣ5дҫӢжӮЈиҖ…з»ҸеӨ„зҗҶеҗҺжҒўеӨҚжӯЈеёёпјҲ1дҫӢжӮЈиҖ…еҮҸдҪҺеүӮйҮҸпјӣ4дҫӢжӮЈиҖ…еҸҰз»ҷдәҲжҠ—й«ҳиЎҖеҺӢиҚҜжҲ–еҲ©е°ҝеүӮжІ»з–—пјүпјӣ6дҫӢжӮЈиҖ…з»“жқҹз ”з©¶дҪҶжІЎжңүжҒўеӨҚжғ…еҶөзҡ„и®°еҪ•гҖӮжӯӨеӨ–пјҢиҲ’е°јжӣҝе°јз»„жңү3дҫӢпјҲ1%пјүжӮЈиҖ…еҮәзҺ°3зә§е·Ұеҝғе®Ө收缩еҠҹиғҪдёӢйҷҚиҮіLVEF<40%пјҢе…¶дёӯ2дҫӢжӮЈиҖ…жңӘжҺҘеҸ—з ”з©¶иҚҜзү©иҝӣдёҖжӯҘжІ»з–—еҚіжӯ»дәЎгҖӮе®үж…°еүӮз»„ж— жӮЈиҖ…еҮәзҺ°3зә§LVEFдёӢйҷҚгҖӮеңЁиғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјүз ”з©¶1зҡ„еҸҢзӣІжңҹпјҢдёӨз»„еҗ„жңү1дҫӢжӮЈиҖ…пјҲиҲ’е°јжӣҝе°јз»„<1%пјӣе®үж…°еүӮз»„дёә1%пјүжӯ»дәҺеҝғеҠӣиЎ°з«ӯпјӣдёӨз»„еҗ„жңү2дҫӢжӮЈиҖ…пјҲиҲ’е°јжӣҝе°јз»„дёә1%пјӣе®үж…°еүӮз»„дёә2%пјүжІ»з–—еҗҺжӯ»дәҺеҝғи„ҸйӘӨеҒңгҖӮ
еңЁж—ўеҫҖжңӘз»ҸжІ»з–—зҡ„жҷҡжңҹиӮҫз»ҶиғһзҷҢпјҲRCCпјүжӮЈиҖ…зҡ„з ”з©¶дёӯпјҢиҲ’е°јжӣҝе°јз»„е’ҢIFN-з»„еҲҶеҲ«жңү103/375дҫӢпјҲ27%пјүе’Ң54/360дҫӢпјҲ15%пјүзҡ„жӮЈиҖ…еҮәзҺ°LVEFеҖјдҪҺдәҺжӯЈеёёеҖјдёӢйҷҗпјҲLLNпјүпјӣеҲҶеҲ«жңү26дҫӢпјҲ7%пјүе’Ң7дҫӢпјҲ2%пјүзҡ„жӮЈиҖ…еҮәзҺ°LVEFеҖјдҪҺдәҺ50%пјҢдё”иҫғеҹәзәҝеҖјдёӢйҷҚ20%д»ҘдёҠгҖӮиҲ’е°јжӣҝе°јз»„4дҫӢпјҲ1%пјүжӮЈиҖ…еҮәзҺ°е·Ұеҝғе®ӨеҠҹиғҪйҡңзўҚпјҢ2дҫӢпјҲ<1%пјүжӮЈиҖ…иҜҠж–ӯдёәе……иЎҖжҖ§еҝғиЎ°пјҲCHFпјүгҖӮ
еңЁиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨ3жңҹз ”з©¶дёӯпјҢиҲ’е°јжӣҝе°јз»„83дҫӢжӮЈиҖ…дёӯжңү2дҫӢпјҲ2%пјүжҠҘе‘ҠеҸ‘з”ҹеҝғи„ҸиЎ°з«ӯдё”еҜјиҮҙжӯ»дәЎпјҢиҖҢе®үж…°еүӮз»„жӮЈиҖ…ж— гҖӮ
жң¬е“ҒдёҙеәҠз ”з©¶дёӯжҺ’йҷӨдәҶжІ»з–—еүҚ12дёӘжңҲеҶ…еҸ‘з”ҹеҝғи„ҸдәӢ件зҡ„жӮЈиҖ…пјҢеҰӮеҝғиӮҢжў—жӯ»пјҲеҢ…жӢ¬дёҘйҮҚ/дёҚзЁіе®ҡжҖ§еҝғз»һз—ӣпјүгҖҒеҶ зҠ¶еҠЁи„ү/еӨ–е‘ЁеҠЁи„үж—Ғи·Ҝ移жӨҚжңҜгҖҒжңүз—ҮзҠ¶зҡ„е……иЎҖжҖ§еҝғеҠӣиЎ°з«ӯгҖҒи„‘иЎҖз®Ўж„ҸеӨ–жҲ–зҹӯжҡӮжҖ§и„‘зјәиЎҖеҸ‘дҪңжҲ–иӮәж “еЎһзҡ„жӮЈиҖ…гҖӮзӣ®еүҚе°ҡдёҚиғҪжҳҺзЎ®дјҙйҡҸдёҠиҝ°з—ҮзҠ¶зҡ„жӮЈиҖ…еҸ‘еұ•дёәжң¬е“Ғзӣёе…іжҖ§е·Ұеҝғе®ӨеҠҹиғҪйҡңзўҚзҡ„йЈҺйҷ©жҳҜеҗҰдјҡеўһй«ҳгҖӮе»әи®®еӨ„ж–№еҢ»з”ҹиҮӘиЎҢжқғиЎЎиҚҜзү©еә”з”Ёд»·еҖјеҸҠе…¶жҪңеңЁзҡ„йЈҺйҷ©гҖӮжӯӨзұ»жӮЈиҖ…жҺҘеҸ—жң¬е“ҒжІ»з–—ж—¶пјҢеә”д»”з»Ҷзӣ‘жөӢе…¶е……иЎҖжҖ§еҝғеҠӣиЎ°з«ӯзҡ„дёҙеәҠз—ҮзҠ¶е’ҢдҪ“еҫҒпјҢд№ҹеә”иҖғиҷ‘иҝӣиЎҢеҹәзәҝе’Ңе®ҡжңҹLVEFиҜ„дј°гҖӮеҜ№дәҺжІЎжңүеҝғи„ҸеҚұйҷ©еӣ зҙ зҡ„жӮЈиҖ…пјҢеә”иҖғиҷ‘иҝӣиЎҢеҹәзәҝе°„иЎҖеҲҶж•°зҡ„иҜ„дј°гҖӮ
QTй—ҙжңҹ延й•ҝе’Ңе°–з«ҜжүӯиҪ¬еһӢе®ӨжҖ§еҝғеҠЁиҝҮйҖҹ
жң¬е“ҒеҸҜеј•иө·QTй—ҙжңҹ延й•ҝпјҢдё”е‘ҲеүӮйҮҸдҫқиө–жҖ§гҖӮQTй—ҙжңҹ延й•ҝеҸҜиғҪдјҡеҜјиҮҙе®ӨжҖ§еҝғеҫӢеӨұеёёзҡ„йЈҺйҷ©еўһеҠ пјҢеҢ…жӢ¬е°–з«ҜжүӯиҪ¬еһӢе®ӨжҖ§еҝғеҠЁиҝҮйҖҹгҖӮжҺҘеҸ—жң¬е“ҒжІ»з–—зҡ„жӮЈиҖ…дёӯпјҢи§ӮеҜҹеҲ°дёҚеҲ°0.1%зҡ„жӮЈиҖ…еҮәзҺ°е°–з«ҜжүӯиҪ¬еһӢе®ӨжҖ§еҝғеҠЁиҝҮйҖҹгҖӮ
зӣ‘жөӢжңүQTй—ҙжңҹ延й•ҝз—…еҸІзҡ„жӮЈиҖ…гҖҒжңҚз”ЁжҠ—еҝғеҫӢеӨұеёёжҲ–еҸҜ延й•ҝQTй—ҙжңҹиҚҜзү©зҡ„жӮЈиҖ…жҲ–иҖ…жңүзӣёе…іеҹәзЎҖеҝғи„Ҹз–ҫз—…гҖҒеҝғеҠЁиҝҮзј“е’Ңз”өи§ЈиҙЁзҙҠд№ұзҡ„жӮЈиҖ…гҖӮеә”з”Ёжң¬е“Ғж—¶пјҢеә”иҖғиҷ‘еңЁжІ»з–—жңҹй—ҙе®ҡжңҹзӣ‘жөӢеҝғз”өеӣҫе’Ңз”өи§ЈиҙЁпјҲй•Ғе’Ңй’ҫпјүгҖӮдёҺCYP3A4ејәжҠ‘еҲ¶еүӮеҗҲ并用иҚҜж—¶пјҢеҸҜиғҪдјҡеўһеҠ иҲ’е°јжӣҝе°јиЎҖжөҶиҚҜзү©жө“еәҰпјҢеә”иҖғиҷ‘йҷҚдҪҺжң¬е“Ғзҡ„еүӮйҮҸпјҲи§ҒгҖҗз”Ёжі•е’Ңз”ЁйҮҸгҖ‘пјүгҖӮ
й«ҳиЎҖеҺӢ
зӣ‘жөӢжӮЈиҖ…жҳҜеҗҰеҸ‘з”ҹй«ҳиЎҖеҺӢпјҢе№¶ж №жҚ®йңҖиҰҒиҝӣиЎҢж ҮеҮҶзҡ„йҷҚеҺӢжІ»з–—гҖӮеҰӮжһңеҸ‘з”ҹдёҘйҮҚй«ҳиЎҖеҺӢпјҢе»әи®®жҡӮж—¶еҒңз”Ёжң¬е“ҒпјҢзӣҙиҮій«ҳиЎҖеҺӢеҫ—еҲ°жҺ§еҲ¶гҖӮ
ж—ўеҫҖжңӘз»ҸжІ»з–—зҡ„жҷҡжңҹиӮҫз»ҶиғһзҷҢпјҲRCCпјүз ”з©¶дёӯпјҢиҲ’е°јжӣҝе°јз»„е’ҢIFN-з»„еҲҶеҲ«жңү127/375дҫӢпјҲ34%пјүе’Ң13/360дҫӢпјҲ4%пјүзҡ„жӮЈиҖ…еҮәзҺ°дәҶй«ҳиЎҖеҺӢпјӣе…¶дёӯ3зә§й«ҳиЎҖеҺӢеҲҶеҲ«дёә50/375дҫӢпјҲ13%пјүе’Ң1/360дҫӢпјҲ<1%пјүгҖӮ21/375дҫӢпјҲ6%пјүжӮЈиҖ…еӣ й«ҳиЎҖеҺӢеҜјиҮҙжң¬е“ҒеүӮйҮҸйҷҚдҪҺжҲ–жҡӮ时延иҝҹз»ҷиҚҜгҖӮ4дҫӢеӣ й«ҳиЎҖеҺӢеҜјиҮҙдёӯж–ӯжІ»з–—пјҢе…¶дёӯ1дҫӢжҳҜжҒ¶жҖ§й«ҳиЎҖеҺӢжӮЈиҖ…гҖӮ
иғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјүз ”з©¶дёӯпјҢиҲ’е°јжӣҝе°јз»„е’Ңе®үж…°еүӮз»„еҗ„дёӘзә§еҲ«й«ҳиЎҖеҺӢзҡ„еҸ‘з”ҹжғ…еҶөзӣёдјјгҖӮиҲ’е°јжӣҝе°јз»„3зә§й«ҳиЎҖеҺӢдёә9/202дҫӢпјҲ4%пјүпјӣе®үж…°еүӮз»„жңӘи§ӮеҜҹеҲ°3зә§й«ҳиЎҖеҺӢгҖӮж— жӮЈиҖ…еӣ й«ҳиЎҖеҺӢиҖҢдёӯж–ӯжІ»з–—гҖӮ
еңЁиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјҲpNETпјү3жңҹз ”з©¶дёӯпјҢ22/83дҫӢпјҲ27%пјүиҲ’е°јжӣҝе°јз»„жӮЈиҖ…е’Ң4/82дҫӢпјҲ5%пјүе®үж…°еүӮз»„жӮЈиҖ…еҸ‘з”ҹй«ҳиЎҖеҺӢгҖӮе…¶дёӯ83дҫӢиҲ’е°јжӣҝе°јз»„иғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨжӮЈиҖ…дёӯжңү8дҫӢпјҲ10%пјүжҠҘе‘Ҡ3зә§й«ҳиЎҖеҺӢпјҢиҖҢ82дҫӢе®үж…°еүӮз»„жӮЈиҖ…дёә1дҫӢпјҲ1%пјүгҖӮ7/83дҫӢпјҲ8%пјүиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨжӮЈиҖ…еӣ й«ҳиЎҖеҺӢеҜјиҮҙжң¬е“ҒеүӮйҮҸйҷҚдҪҺжҲ–жҡӮ时延иҝҹз»ҷиҚҜгҖӮ1дҫӢеӣ й«ҳиЎҖеҺӢеҜјиҮҙдёӯж–ӯжІ»з–—гҖӮ
ж— 4зә§й«ҳиЎҖеҺӢзҡ„жҠҘе‘ҠгҖӮ
ж—ўеҫҖжңӘз»ҸжІ»з–—зҡ„жҷҡжңҹиӮҫз»ҶиғһзҷҢпјҲRCCпјүз ”з©¶дёӯпјҢиҲ’е°јжӣҝе°јз»„32/375дҫӢпјҲ9%пјүе’ҢIFN-з»„3/360дҫӢпјҲ1%пјүжӮЈиҖ…еҸ‘з”ҹдәҶдёҘйҮҚй«ҳиЎҖеҺӢпјҲ收缩еҺӢ>200mmHgжҲ–иҲ’еј еҺӢ>110mmHgпјүгҖӮиғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјүз ”з©¶дёӯпјҢиҲ’е°јжӣҝе°јз»„8/202дҫӢпјҲ4%пјүе’Ңе®үж…°еүӮз»„1/102дҫӢпјҲ1%пјүзҡ„жӮЈиҖ…еҸ‘з”ҹдәҶдёҘйҮҚй«ҳиЎҖеҺӢгҖӮиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨз ”з©¶дёӯпјҢиҲ’е°јжӣҝе°јз»„8/80дҫӢпјҲ10%пјүе’Ңе®үж…°еүӮз»„2/76дҫӢпјҲ3%пјүеҸ‘з”ҹдёҘйҮҚй«ҳиЎҖеҺӢгҖӮ
еҮәиЎҖдәӢ件е’ҢиғғиӮ з©ҝеӯ”
дёҠеёӮеҗҺжҠҘе‘ҠдёӯпјҢжӣҫжҠҘе‘ҠеҮәиЎҖдәӢ件пјҢеҢ…жӢ¬иғғиӮ йҒ“гҖҒе‘јеҗёзі»з»ҹгҖҒиӮҝзҳӨгҖҒжіҢе°ҝйҒ“е’Ңи„‘еҮәиЎҖпјҢйғЁеҲҶдёәиҮҙжӯ»жҖ§гҖӮ
жҷҡжңҹиӮҫз»ҶиғһзҷҢпјҲRCCпјүз ”з©¶дёӯпјҢиҲ’е°јжӣҝе°јз»„140/375дҫӢпјҲ37%пјүе’ҢIFN-з»„35/360дҫӢпјҲ10%пјүжӮЈиҖ…еҸ‘з”ҹдәҶеҮәиЎҖдәӢ件гҖӮеӨ§йғЁеҲҶдёә1зә§жҲ–2зә§пјӣд»…жңү1дҫӢж—ўеҫҖжңӘз»ҸжІ»з–—зҡ„жӮЈиҖ…еҸ‘з”ҹ5зә§иғғеҮәиЎҖгҖӮ
иғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјүз ”з©¶1зҡ„еҸҢзӣІжңҹпјҢиҲ’е°јжӣҝе°јз»„37/202дҫӢпјҲ18%пјүе’Ңе®үж…°еүӮз»„17/102дҫӢпјҲ17%пјүжӮЈиҖ…еҸ‘з”ҹдәҶеҮәиЎҖдәӢ件гҖӮдёӨз»„еҲҶеҲ«жңү14/202дҫӢпјҲ7%пјүе’Ң9/102дҫӢпјҲ9%пјүжӮЈиҖ…еҸ‘з”ҹ3жҲ–4зә§еҮәиЎҖдәӢ件гҖӮжӯӨеӨ–пјҢе®үж…°еүӮз»„жңү1дҫӢжӮЈиҖ…еңЁжІ»з–—第2е‘ЁжңҹеҮәзҺ°иҮҙжӯ»жҖ§иғғиӮ йҒ“еҮәиЎҖгҖӮ
еңЁиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјҲpNETпјү3жңҹз ”з©¶дёӯпјҢ18/83дҫӢпјҲ22%пјүиҲ’е°јжӣҝе°јз»„жӮЈиҖ…еҸ‘з”ҹйҷӨйј»иЎ„д№ӢеӨ–зҡ„еҮәиЎҖдәӢ件пјҢиҖҢе®үж…°еүӮз»„дёә8/82дҫӢпјҲ10%пјүгҖӮ17/83дҫӢпјҲ20%пјүиҲ’е°јжӣҝе°јз»„жӮЈиҖ…еҸ‘з”ҹйј»иЎ„пјҢиҖҢе®үж…°еүӮз»„дёә4дҫӢпјҲ5%пјүгҖӮиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨз ”з©¶дёӯпјҢ1/83дҫӢпјҲ1%пјүиҲ’е°јжӣҝе°јз»„жӮЈиҖ…еҸ‘з”ҹ3зә§йј»иЎ„пјҢж— дёҖдҫӢжӮЈиҖ…еҸ‘з”ҹе…¶е®ғ3жҲ–4зә§еҮәиЎҖдәӢ件гҖӮиҖҢе®үж…°еүӮз»„жӮЈиҖ…3/82дҫӢпјҲ4%пјүеҸ‘з”ҹ3жҲ–4зә§еҮәиЎҖдәӢ件гҖӮ
йј»иЎ„жҳҜжңҖеёёи§Ғзҡ„еҮәиЎҖжҖ§дёҚиүҜеҸҚеә”пјҢиҖҢиғғиӮ еҮәиЎҖжҳҜжңҖеёёи§Ғзҡ„вүҘ3зә§дәӢ件гҖӮ
иҲ’е°јжӣҝе°јжІ»з–—зҡ„жӮЈиҖ…дёӯжӣҫи§ӮеҜҹеҲ°иӮҝзҳӨзӣёе…іжҖ§еҮәиЎҖгҖӮиҝҷдәӣдәӢ件еҸҜиғҪдјҡзӘҒ然еҸ‘з”ҹпјҢиӮәйғЁиӮҝзҳӨжӮЈиҖ…еҸҜиғҪдјҡеҸ‘з”ҹдёҘйҮҚе’ҢеҚұеҸҠз”ҹе‘Ҫзҡ„е’ҜиЎҖжҲ–иӮәж “еЎһгҖӮеҜ№дәҺдҪҝз”ЁиҲ’е°јжӣҝе°јжІ»з–—иҪ¬з§»жҖ§иӮҫз»ҶиғһзҷҢгҖҒиғғиӮ й—ҙиҙЁзҳӨе’ҢиҪ¬з§»жҖ§иӮәзҷҢзҡ„жӮЈиҖ…пјҢеңЁдёҙеәҠиҜ•йӘҢдёӯжӣҫи§ӮеҜҹеҲ°иӮәеҮәиЎҖз—…дҫӢпјҢе…¶дёӯжҹҗдәӣжҳҜиҮҙе‘ҪжҖ§зҡ„пјҢиҝҷз§Қжғ…еҶөеңЁдёҠеёӮеҗҺдҪҝз”ЁиҝҮзЁӢдёӯд№ҹжңүжҠҘйҒ“гҖӮе°ҡжңӘжү№еҮҶжң¬е“ҒеңЁиӮәзҷҢжӮЈиҖ…дёӯеә”з”ЁгҖӮеҜ№дәҺеҮәиЎҖдәӢ件зҡ„дёҙеәҠиҜ„дј°еә”еҢ…жӢ¬иҝһз»ӯе…ЁиЎҖз»Ҷиғһи®Ўж•°пјҲCBCsпјүе’ҢдҪ“жЈҖгҖӮ
дёҘйҮҚдё”жңүж—¶иҮҙжӯ»жҖ§зҡ„иғғиӮ йҒ“并еҸ‘з—ҮпјҲеҢ…жӢ¬иғғиӮ з©ҝеӯ”пјүжӣҫжҠҘе‘ҠдәҺжҺҘеҸ—жң¬е“ҒжІ»з–—зҡ„и…№и…”еҶ…иӮҝзҳӨжӮЈиҖ…гҖӮ
иғғиӮ йҒ“дәӢ件
жҒ¶еҝғгҖҒи…№жі»гҖҒеҸЈи…”зӮҺгҖҒж¶ҲеҢ–дёҚиүҜе’Ңе‘•еҗҗжҳҜжңҖеёёжҠҘе‘Ҡзҡ„жІ»з–—зӣёе…іжҖ§иғғиӮ йҒ“дёҚиүҜеҸҚеә”гҖӮй’ҲеҜ№йңҖиҰҒжІ»з–—зҡ„иғғиӮ йҒ“дёҚиүҜеҸҚеә”зҡ„ж”ҜжҢҒжҖ§жҠӨзҗҶеҸҜеҢ…жӢ¬жӯўеҗҗжҲ–жӯўжі»иҚҜгҖӮ
иғ°и…әзӮҺ
еңЁиҲ’е°јжӣҝе°јдёҙеәҠиҜ•йӘҢдёӯпјҢжӣҫжҠҘе‘ҠиҝҮиғ°и…әзӮҺгҖӮеңЁжҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—зҡ„еҗ„з§Қе®һдҪ“зҳӨжӮЈиҖ…дёӯжӣҫи§ӮеҜҹеҲ°иЎҖжё…и„ӮиӮӘй…¶е’Ңж·ҖзІүй…¶еҚҮй«ҳзҡ„жғ…еҶөгҖӮеңЁжӮЈжңүеҗ„з§Қе®һдҪ“зҳӨзҡ„жӮЈиҖ…дёӯпјҢи„ӮиӮӘй…¶ж°ҙе№іеҚҮй«ҳжҳҜжҡӮж—¶жҖ§зҡ„пјҢдёҖиҲ¬жғ…еҶөдёӢдёҚдјҙйҡҸжңүиғ°и…әзӮҺзҡ„дҪ“еҫҒжҲ–з—ҮзҠ¶гҖӮеҰӮжһңеҮәзҺ°иғ°и…әзӮҺз—ҮзҠ¶пјҢжӮЈиҖ…еә”еҒңз”ЁиҲ’е°јжӣҝе°јпјҢ并жҺҘеҸ—йҖӮеҪ“зҡ„ж”ҜжҢҒжҖ§жҠӨзҗҶгҖӮ
з”ІзҠ¶и…әеҠҹиғҪдёҚе…Ё
е»әи®®иҝӣиЎҢеҹәзәҝз”ІзҠ¶и…әеҠҹиғҪзҡ„е®һйӘҢе®ӨжЈҖжҹҘпјҢз”ІзҠ¶и…әеҠҹиғҪеҮҸйҖҖжҲ–дәўиҝӣзҡ„жӮЈиҖ…еңЁжҺҘеҸ—жң¬е“ҒжІ»з–—д№ӢеүҚеә”з»ҷдәҲзӣёеә”зҡ„ж ҮеҮҶжІ»з–—гҖӮжүҖжңүжӮЈиҖ…еә”еңЁжҺҘеҸ—жң¬е“ҒжІ»з–—ж—¶еҜҶеҲҮзӣ‘жөӢз”ІзҠ¶и…әеҠҹиғҪдёҚе…Ёзҡ„з—ҮзҠ¶е’ҢдҪ“еҫҒпјҢеҢ…еҗ«з”ІзҠ¶и…әеҠҹиғҪеҮҸйҖҖгҖҒз”ІзҠ¶и…әеҠҹиғҪдәўиҝӣе’Ңз”ІзҠ¶и…әзӮҺгҖӮеҜ№жңүз”ІзҠ¶и…әеҠҹиғҪдёҚе…Ёз—ҮзҠ¶е’ҢдҪ“еҫҒзҡ„жӮЈиҖ…еә”иҝӣиЎҢз”ІзҠ¶и…әеҠҹиғҪзҡ„е®һйӘҢе®Өзӣ‘жөӢпјҢ并зӣёеә”з»ҷдәҲж ҮеҮҶжІ»з–—гҖӮ
дёҙеәҠиҜ•йӘҢе’ҢдёҠеёӮеҗҺз”ЁиҚҜз»ҸйӘҢд№ҹжҠҘйҒ“дәҶдёҖдәӣз”ІзҠ¶и…әеҠҹиғҪдәўиҝӣдәӢ件пјҢйғЁеҲҶеҗҺз»ӯжңүз”ІзҠ¶и…әеҠҹиғҪеҮҸйҖҖеҸ‘з”ҹгҖӮ
з—«жҖ§еҸ‘дҪң
еңЁиҲ’е°јжӣҝе°јзҡ„дёҙеәҠз ”з©¶дёӯпјҢе…·жңүи„‘иҪ¬з§»ж”ҫе°„еӯҰиҜҒжҚ®зҡ„жӮЈиҖ…еҮәзҺ°дәҶз—«жҖ§еҸ‘дҪңгҖӮжӯӨеӨ–пјҢжңүжһҒе°‘ж•°пјҲ<1%пјүжӮЈиҖ…еҮәзҺ°з—«жҖ§еҸ‘дҪңе’ҢеҸҜйҖҶжҖ§еҗҺйғЁзҷҪиҙЁи„‘з—…з»јеҗҲеҫҒпјҲRPLSпјүзҡ„ж”ҫе°„еӯҰиҜҒжҚ®пјҢйғЁеҲҶдёәиҮҙжӯ»жҖ§гҖӮеҰӮжһңжӮЈиҖ…з—«жҖ§еҸ‘дҪңжҲ–еҮәзҺ°з¬ҰеҗҲRPLSзҡ„дҪ“еҫҒ/з—ҮзҠ¶пјҲеҰӮй«ҳиЎҖеҺӢгҖҒеӨҙз—ӣгҖҒиӯҰи§үдёӢйҷҚгҖҒеҝғзҗҶжңәиғҪж”№еҸҳе’Ңи§ҶеҠӣдё§еӨұпјҢеҢ…жӢ¬зҡ®иҙЁзӣІпјүпјҢеә”йҖҡиҝҮеҢ»з–—з®ЎзҗҶжҺ§еҲ¶з—…з—ҮпјҢеҢ…жӢ¬жҺ§еҲ¶й«ҳиЎҖеҺӢгҖӮе»әи®®жҡӮж—¶еҒңз”ЁиҲ’е°јжӣҝе°јпјӣеңЁз—ҮзҠ¶зј“и§ЈеҗҺпјҢеҸҜж №жҚ®дё»жІ»еҢ»з”ҹзҡ„еҲӨж–ӯ继з»ӯжІ»з–—гҖӮ
дјӨеҸЈж„ҲеҗҲ
жҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—зҡ„жӮЈиҖ…жӣҫжҠҘе‘ҠеҮәзҺ°дјӨеҸЈж„ҲеҗҲзј“ж…ўгҖӮе»әи®®жӯЈеңЁиҝӣиЎҢйҮҚеӨ§еӨ–科жүӢжңҜзҡ„жӮЈиҖ…жҡӮеҒңз»ҷиҚҜд»Ҙйў„йҳІиҜҘзҺ°иұЎеҸ‘з”ҹгҖӮеҜ№дәҺйҮҚеӨ§еӨ–科жүӢжңҜеҗҺдҪ•ж—¶ејҖе§ӢжІ»з–—зҡ„дёҙеәҠз»ҸйӘҢжңүйҷҗгҖӮеӣ жӯӨеә”ж №жҚ®жҺҘеҸ—йҮҚеӨ§еӨ–科жүӢжңҜеҗҺжӮЈиҖ…зҡ„еә·еӨҚзЁӢеәҰпјҢз”ұдёҙеәҠеҲӨж–ӯжҳҜеҗҰйҮҚж–°ејҖе§Ӣз»ҷиҚҜгҖӮ
дёӢйўҢйӘЁеқҸжӯ»пјҲONJпјү
дёҙеәҠз ”з©¶дёӯзҪ•и§ҒONJпјҢдёҠеёӮеҗҺз”ЁиҚҜжӣҫжҠҘе‘ҠONJгҖӮеӨ§йғЁеҲҶеҮәзҺ°ONJзҡ„жӮЈиҖ…еқҮж—ўеҫҖжҲ–дјҙйҡҸеҸҢиҶҰй…ёй…Ҝйқҷи„үз»ҷиҚҜпјҢиҝҷжҳҜе·ІзЎ®и®Өзҡ„еҸҜиғҪеј•иө·ONJзҡ„йЈҺйҷ©еӣ зҙ гҖӮеӣ жӯӨж— и®әеҗҲ并жҲ–еәҸиҙҜз»ҷдәҲиҲ’е°јжӣҝе°је’ҢеҸҢзЈ·й…ёзӣҗйқҷи„үз»ҷиҚҜпјҢеқҮйңҖзү№еҲ«жіЁж„ҸгҖӮ
дҫөе…ҘжҖ§зүҷ科жүӢжңҜд№ҹиў«зЎ®и®Өдёәдјҡеј•иө·ONJзҡ„йЈҺйҷ©еӣ зҙ гҖӮеңЁз»ҷдәҲиҲ’е°јжӣҝе°јжІ»з–—еүҚеә”иҖғиҷ‘иҝӣиЎҢзүҷ科жЈҖжҹҘеҸҠйҖӮеҪ“зҡ„йў„йҳІжҖ§жҺӘж–ҪгҖӮж—ўеҫҖжҲ–дјҙйҡҸеҸҢзЈ·й…ёзӣҗйқҷи„үз»ҷиҚҜгҖҒдҫөе…ҘжҖ§зүҷ科жүӢжңҜзҡ„жӮЈиҖ…еә”йҒҝе…ҚжҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—гҖӮ
иӮҝзҳӨжә¶и§Јз»јеҗҲеҫҒпјҲTLSпјү
еңЁдёҙеәҠиҜ•йӘҢдёӯжӣҫеҸ‘з”ҹиҮҙжӯ»жҖ§зҡ„иӮҝзҳӨжә¶и§Јз»јеҗҲз—ҮTLSпјҢиҖҢеңЁдёҠеёӮеҗҺзҡ„еә”з”Ёдёӯд№ҹжңүжӯӨзұ»жҠҘйҒ“гҖӮжҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—еүҚиӮҝзҳӨиҙҹиҚ·й«ҳзҡ„жӮЈиҖ…еҸ‘з”ҹTLSзҡ„йЈҺйҷ©иҫғй«ҳпјҢз»ҷдәҲдёҘеҜҶзӣ‘жөӢпјҢж №жҚ®з—…жғ…й…Ңжғ…з”ЁиҚҜгҖӮ
иЎҖж “еҫ®иЎҖз®Ўз—…
еңЁиҲ’е°јжӣҝе°јеҚ•иҚҜе’ҢиҒ”еҗҲиҙқдјҗзҸ еҚ•жҠ—з”ЁиҚҜзҡ„дёҙеәҠиҜ•йӘҢе’ҢдёҠеёӮеҗҺз»ҸйӘҢдёӯпјҢеҸ‘з”ҹиҝҮиЎҖж “еҫ®иЎҖз®Ўз—…пјҲTMAпјүпјҢеҢ…жӢ¬иЎҖж “жҖ§иЎҖе°ҸжқҝеҮҸе°‘жҖ§зҙ«зҷңгҖҒжә¶иЎҖжҖ§е°ҝжҜ’з»јеҗҲеҫҒпјҢжңүж—¶з”ҡиҮіеҜјиҮҙиӮҫеҠҹиғҪиЎ°з«ӯжҲ–иҮҙе‘ҪжҖ§гҖӮеҮәзҺ°TMAзҡ„жӮЈиҖ…еә”з»ҲжӯўиҲ’е°јжӣҝе°јжІ»з–—гҖӮеҒңиҚҜеҗҺе·Іи§ӮеҜҹеҲ°TMAз—…жғ…йҖҶиҪ¬гҖӮ
еқҸжӯ»жҖ§зӯӢиҶңзӮҺ
жӣҫжҠҘе‘ҠзҪ•и§Ғзҡ„еҢ…жӢ¬дјҡйҳҙеңЁеҶ…зҡ„еқҸжӯ»жҖ§зӯӢиҶңзӮҺз—…дҫӢпјҢйғЁеҲҶдёәиҮҙжӯ»жҖ§гҖӮеҮәзҺ°еқҸжӯ»жҖ§зӯӢиҶңзӮҺзҡ„жӮЈиҖ…еә”з»ҲжӯўиҲ’е°јжӣҝе°јжІ»з–—пјҢ并з«ӢеҚіжҺҘеҸ—йҖӮеҪ“зҡ„жІ»з–—гҖӮ
иӣӢзҷҪе°ҝ
жӣҫжңүиӣӢзҷҪе°ҝе’ҢиӮҫз—…з»јеҗҲеҫҒзҡ„жҠҘйҒ“гҖӮжңүдәӣз—…дҫӢдјҡеҜјиҮҙиӮҫеҠҹиғҪиЎ°з«ӯе’ҢиҮҙе‘ҪжҖ§гҖӮеә”зӣ‘жҺ§жӮЈиҖ…иӣӢзҷҪе°ҝеҮәзҺ°жҲ–еҠ йҮҚгҖӮжІ»з–—жңҹй—ҙиҝӣиЎҢеҹәзәҝе’Ңе®ҡжңҹе°ҝеҲҶжһҗпјҢж №жҚ®дёҙеәҠжҢҮеҫҒиҝӣиЎҢ24е°Ҹж—¶зҡ„е°ҝиӣӢзҷҪеҗҺз»ӯжөӢе®ҡгҖӮеҜ№24е°Ҹж—¶зҡ„е°ҝиӣӢзҷҪвүҘ3gзҡ„жӮЈиҖ…пјҢдёӯж–ӯиҲ’е°јжӣҝ尼治疗并йҷҚдҪҺеүӮйҮҸгҖӮеҜ№иӮҫз—…з»јеҗҲеҫҒжӮЈиҖ…жҲ–йҷҚдҪҺеүӮйҮҸеҗҺе°ҝиӣӢзҷҪвүҘ3gд»ҚйҮҚеӨҚеҮәзҺ°зҡ„жӮЈиҖ…пјҢз»ҲжӯўиҲ’е°јжӣҝе°јжІ»з–—гҖӮе°ҡжңӘзі»з»ҹиҜ„д»·дёӯеәҰиҮійҮҚеәҰиӣӢзҷҪе°ҝжӮЈиҖ…жҢҒз»ӯиҲ’е°јжӣҝе°јжІ»з–—зҡ„е®үе…ЁжҖ§гҖӮ
дҪҺиЎҖзі–з—Ү
иҲ’е°јжӣҝе°јеҸҜеј•еҸ‘дҪҺиЎҖзі–з—ҮпјҢиҖҢдҪҺиЎҖзі–з—ҮеҸҜиғҪеҜјиҮҙж„ҸиҜҶдё§еӨұпјҢжҲ–йңҖиҰҒдҪҸйҷўжІ»з–—гҖӮеңЁдёҙеәҠиҜ•йӘҢдёӯпјҢдҪҝз”ЁиҲ’е°јжӣҝе°јжІ»з–—зҡ„2%зҡ„иғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјүе’ҢжҷҡжңҹиӮҫз»ҶиғһзҷҢпјҲRCCпјүжӮЈиҖ…пјҢе’ҢзәҰ10%зҡ„иғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјҲpNETпјүзҡ„жӮЈиҖ…еҸ‘з”ҹдҪҺиЎҖзі–гҖӮеҜ№дәҺдҪҝз”ЁиҲ’е°јжӣҝе°јжІ»з–—иғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨпјҲpNETпјүзҡ„жӮЈиҖ…пјҢе·ІеӯҳеңЁзҡ„иЎҖзі–ејӮ常并йқһеҸ‘з”ҹеңЁжүҖжңүз»ҸеҺҶдәҶдҪҺиЎҖзі–зҡ„жӮЈиҖ…гҖӮзі–е°ҝз—…жӮЈиҖ…зҡ„иЎҖзі–йҷҚдҪҺеҸҜиғҪжӣҙдёәдёҘйҮҚгҖӮеә”еңЁиҲ’е°јжӣҝе°јжІ»з–—дёӯе’ҢеҒңиҚҜеҗҺпјҢе®ҡжңҹжЈҖжҹҘиЎҖзі–ж°ҙе№ігҖӮиҜ„дј°жҳҜеҗҰйңҖиҰҒи°ғж•ҙжҠ—зі–е°ҝз—…иҚҜзү©зҡ„еүӮйҮҸпјҢд»ҘйҷҚдҪҺдҪҺиЎҖзі–йЈҺйҷ©гҖӮ
иғҡиғҺ-иғҺе„ҝжҜ’жҖ§
еҹәдәҺеҠЁзү©з ”究结жһңеҸҠе…¶дҪңз”ЁжңәеҲ¶пјҢеҰҠеЁ еҘіжҖ§дҪҝз”Ёжң¬е“Ғж—¶еҸҜеҜ№иғҺе„ҝйҖ жҲҗеҚұе®ігҖӮпјҲи§ҒгҖҗиҚҜзҗҶжҜ’зҗҶгҖ‘пјү
еә”е‘ҠзҹҘеҰҠеЁ еҘіжҖ§дҪҝз”Ёжң¬е“ҒеҜ№иғҺе„ҝзҡ„жҪңеңЁйЈҺйҷ©гҖӮе»әи®®жңүз”ҹиӮІиғҪеҠӣзҡ„еҘіжҖ§еңЁжң¬е“ҒжІ»з–—жңҹй—ҙеҸҠжң«ж¬Ўз”ЁиҚҜеҗҺ4е‘ЁеҶ…йҮҮеҸ–жңүж•Ҳзҡ„йҒҝеӯ•жҺӘж–ҪпјҲи§ҒгҖҗиҚҜзҗҶжҜ’зҗҶгҖ‘е’ҢгҖҗеӯ•еҰҮеҸҠе“әд№іжңҹеҰҮеҘіз”ЁиҚҜгҖ‘пјүгҖӮ
еҜ№й©ҫ驶е’ҢдҪҝз”ЁжңәеҷЁиғҪеҠӣзҡ„еҪұе“Қ
жң¬е“ҒеҜ№й©ҫ驶еҸҠж“ҚдҪңжңәжў°иғҪеҠӣзҡ„еҪұе“Қиҫғе°ҸпјҢеә”е‘ҠзҹҘжӮЈиҖ…еңЁдҪҝз”ЁиҲ’е°јжӣҝе°јжІ»з–—жңҹй—ҙеҸҜиғҪдјҡеӨҙжҷ•гҖӮ
гҖҗзҰҒеҝҢгҖ‘
еҜ№жң¬е“ҒжҲ–иҚҜзү©зҡ„йқһжҙ»жҖ§жҲҗд»ҪдёҘйҮҚиҝҮж•ҸиҖ…зҰҒз”ЁгҖӮ
гҖҗеӯ•еҰҮеҸҠе“әд№іжңҹеҰҮеҘіз”ЁиҚҜгҖ‘
еҰҠеЁ
йЈҺйҷ©жҖ»з»“
еҹәдәҺеҠЁзү©з”ҹж®–з ”з©¶еҸҠе…¶дҪңз”ЁжңәеҲ¶пјҢеӯ•еҰҮжҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—еҸҜиғҪдјҡдјӨе®іиғҺе„ҝпјҲи§ҒгҖҗиҚҜзҗҶжҜ’зҗҶгҖ‘пјүгҖӮе°ҡж— еҰҠеЁ еҘіжҖ§дҪҝз”Ёжң¬е“ҒжҠҘе‘ҠиҚҜзү©зӣёе…ійЈҺйҷ©зҡ„еҸҜз”Ёж•°жҚ®гҖӮеңЁеҠЁзү©еҸ‘иӮІе’Ңз”ҹж®–жҜ’жҖ§з ”究дёӯпјҢеҲҶеҲ«еңЁжӮЈиҖ…жҜҸж—ҘжҺЁиҚҗеүӮйҮҸпјҲRDDпјүAUCзҡ„5.5е’Ң0.3еҖҚеүӮйҮҸдёӢпјҢдәҺеҷЁе®ҳеҪўжҲҗжңҹй—ҙеҗ‘еҰҠеЁ еӨ§йј е’Ң家兔з»ҸеҸЈз»ҷдәҲиҲ’е°јжӣҝе°јеҗҺеҸҜи§ҒиҮҙз•ёжҖ§пјҲиғҡиғҺжӯ»дәЎгҖҒйў…йқўйғЁе’ҢйӘЁйӘјз•ёеҪўпјүпјҲи§ҒгҖҗиҚҜзҗҶжҜ’зҗҶгҖ‘пјүгҖӮеә”е‘ҠзҹҘжңүз”ҹиӮІиғҪеҠӣзҡ„еҘіжҖ§иҚҜзү©еҜ№иғҺе„ҝзҡ„жҪңеңЁеҚұе®ігҖӮ
еҜ№дәҺйҖӮеә”дәәзҫӨпјҢйҮҚеӨ§еҮәз”ҹзјәйҷ·е’ҢжөҒдә§зҡ„иғҢжҷҜйЈҺйҷ©жңӘзҹҘгҖӮдҪҶжҳҜеңЁзҫҺеӣҪжҷ®йҖҡдәәзҫӨдёӯпјҢдёҙеәҠзЎ®и®ӨеҰҠеЁ дёӯзҡ„йҮҚеӨ§еҮәз”ҹзјәйҷ·зҡ„иғҢжҷҜйЈҺйҷ©дј°и®ЎеҖјдёә2%-4%пјҢжөҒдә§зҡ„иғҢжҷҜйЈҺйҷ©дёә15%-20%гҖӮ
е“әд№і
жІЎжңүе…ідәҺиҲ’е°јжӣҝе°јеҸҠе…¶д»Ји°ўзү©еӯҳеңЁдәҺдәәд№іжұҒдёӯзҡ„дҝЎжҒҜгҖӮеҪ“жө“еәҰй«ҳиҫҫ12еҖҚиЎҖжөҶж°ҙе№іж—¶пјҢиҲ’е°јжӣҝе°јеҸҠе…¶д»Ји°ўзү©еҸҜеҲҶжіҢиҮіеӨ§йј д№іжұҒдёӯпјҲи§ҒгҖҗиҚҜзҗҶжҜ’зҗҶгҖ‘пјүгҖӮз”ұдәҺжң¬е“ҒеңЁд№іе„ҝдёӯеӯҳеңЁжҪңеңЁдёҘйҮҚдёҚиүҜеҸҚеә”пјҢж•…е»әи®®е“әд№іеҘіжҖ§еңЁжІ»з–—жңҹй—ҙе’Ңжң«ж¬Ўз”ЁиҚҜеҗҺиҮіе°‘4е‘ЁеҶ…дёҚеҫ—е“әд№ігҖӮ
е…·жңүз”ҹж®–иғҪеҠӣзҡ„еҘіжҖ§е’Ңз”·жҖ§
еҹәдәҺеҠЁзү©з”ҹж®–з ”з©¶еҸҠе…¶дҪңз”ЁжңәеҲ¶пјҢеҰҠеЁ еҘіжҖ§дҪҝз”Ёжң¬е“ҒеҸҜиғҪеҜ№иғҺе„ҝйҖ жҲҗеҚұе®іпјҲи§ҒгҖҗиҚҜзҗҶжҜ’зҗҶгҖ‘пјүгҖӮ
еҰҠеЁ иҜ•йӘҢ
еҜ№дәҺе…·жңүз”ҹж®–жҪңиғҪзҡ„еҘіжҖ§пјҢеә”еңЁејҖе§Ӣжң¬е“ҒжІ»з–—еүҚиҝӣиЎҢеҰҠеЁ иҜ•йӘҢгҖӮ
йҒҝеӯ•
еҘіжҖ§
еә”е‘ҠзҹҘе…·жңүз”ҹж®–иғҪеҠӣзҡ„еҘіжҖ§еңЁиҲ’е°јжӣҝе°јжІ»з–—жңҹй—ҙеҸҠжңҖеҗҺдёҖж¬Ўз»ҷиҚҜеҗҺиҮіе°‘4е‘ЁеҶ…йҮҮеҸ–жңүж•Ҳзҡ„йҒҝеӯ•жҺӘж–ҪгҖӮ
з”·жҖ§
еҹәдәҺеҠЁзү©з”ҹж®–з ”з©¶з»“жһңпјҢе»әи®®жңүз”ҹиӮІиғҪеҠӣеҘіжҖ§дјҙдҫЈзҡ„з”·жҖ§жӮЈиҖ…еңЁжҺҘеҸ—жң¬е“ҒжІ»з–—жңҹй—ҙеҸҠжңҖеҗҺдёҖж¬Ўз»ҷиҚҜеҗҺиҮіе°‘7е‘ЁеҶ…йҮҮеҸ–жңүж•ҲйҒҝеӯ•жҺӘж–ҪгҖӮ
дёҚиӮІ
ж №жҚ®еҠЁзү©з ”究зӣёе…іеҸ‘зҺ°пјҢиҲ’е°јжӣҝе°јжІ»з–—еҸҜжҚҹе®із”·жҖ§е’ҢеҘіжҖ§зҡ„з”ҹиӮІиғҪеҠӣпјҲи§ҒгҖҗиҚҜзҗҶжҜ’зҗҶгҖ‘пјүгҖӮ
гҖҗе„ҝз«Ҙз”ЁиҚҜгҖ‘
жң¬е“Ғз”ЁдәҺе„ҝз«ҘжӮЈиҖ…зҡ„е®үе…ЁжҖ§е’Ңжңүж•ҲжҖ§е°ҡжңӘжҳҺзЎ®гҖӮ
зӣ®еүҚе·Іжңүзҡ„жңүйҷҗж•°жҚ®и§ҒгҖҗдёҚиүҜеҸҚеә”гҖ‘пјҢдҪҶе°ҡдёҚжҺЁиҚҗжң¬е“Ғеә”з”ЁдәҺиҜҘдәәзҫӨгҖӮ
гҖҗиҖҒе№ҙз”ЁиҚҜгҖ‘
жҺҘеҸ—жң¬е“ҒжІ»з–—зҡ„825дҫӢиғғиӮ й—ҙиҙЁзҳӨпјҲGISTпјүжҲ–иҪ¬з§»жҖ§иӮҫз»ҶиғһзҷҢпјҲRCCпјүжӮЈиҖ…дёӯжңү277дҫӢпјҲ34%пјүе№ҙйҫ„еңЁ65еІҒжҲ–65еІҒд»ҘдёҠгҖӮеңЁиғ°и…әзҘһз»ҸеҶ…еҲҶжіҢзҳӨз ”з©¶дёӯпјҢ22дҫӢпјҲ27%пјүжҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—зҡ„жӮЈиҖ…дёә65еІҒеҸҠ65еІҒд»ҘдёҠгҖӮжңӘеҸ‘зҺ°е№ҙиҪ»жӮЈиҖ…дёҺиҖҒе№ҙжӮЈиҖ…еңЁе®үе…ЁжҖ§жҲ–жңүж•ҲжҖ§ж–№йқўеӯҳеңЁе·®ејӮгҖӮ
гҖҗиҚҜзү©зӣёдә’дҪңз”ЁгҖ‘
CYP3A4жҠ‘еҲ¶еүӮпјҡCYP3A4ејәжҠ‘еҲ¶еүӮпјҢеҰӮй…®еә·е”‘пјҢеҸҜеўһеҠ иҲ’е°јжӣҝе°јзҡ„иЎҖжөҶжө“еәҰгҖӮе»әи®®йҖүжӢ©еҜ№жӯӨзұ»й…¶жІЎжңүжҲ–жҠ‘еҲ¶дҪңз”ЁжңҖе°Ҹзҡ„еҗҲ并用иҚҜгҖӮеҒҘеә·еҝ—ж„ҝиҖ…жңҚз”ЁеҚ•еүӮйҮҸиӢ№жһңй…ёиҲ’е°јжӣҝе°јпјҢеҗҢж—¶з»ҷдәҲCYP3A4ејәжҠ‘еҲ¶еүӮпјҲй…®еә·е”‘пјүпјҢеҸҜеҜјиҮҙжҖ»дҪ“пјҲиҲ’е°јжӣҝе°јеҸҠе…¶дё»иҰҒжҙ»жҖ§д»Ји°ўдә§зү©пјүзҡ„Cmaxе’ҢAUC0-вҲһеҲҶеҲ«еўһеҠ 49%е’Ң51%гҖӮиҲ’е°јжӣҝе°јдёҺCYP3A4й…¶зі»ејәжҠ‘еҲ¶еүӮпјҲдҫӢеҰӮпјҡй…®еә·е”‘гҖҒдјҠжӣІеә·е”‘гҖҒе…ӢжӢүйңүзҙ гҖҒйҳҝжүҺйӮЈйҹҰгҖҒеҚ°ең°йӮЈйҹҰгҖҒиҗҳжі•е”‘й…®гҖҒйӮЈйқһйӮЈйҹҰгҖҒеҲ©жүҳйӮЈйҹҰгҖҒжІҷеҘҺйӮЈйҹҰгҖҒжі°еҲ©йңүзҙ гҖҒдјҸз«Ӣеә·е”‘пјүеҗҢж—¶еә”з”Ёж—¶пјҢеҸҜеўһеҠ иҲ’е°јжӣҝе°јжө“еәҰпјҢи‘Ўиҗ„жҹҡд№ҹеҸҜеўһеҠ иҲ’е°јжӣҝе°јзҡ„иЎҖиҚҜжө“еәҰгҖӮеҰӮжһңеҝ…йЎ»дёҺCYP3A4ејәжҠ‘еҲ¶еүӮеҗҢж—¶еә”з”Ёж—¶пјҢйңҖиҰҒиҖғиҷ‘йҷҚдҪҺжң¬е“ҒеүӮйҮҸпјҲи§ҒгҖҗз”ЁйҮҸе’Ңз”Ёжі•гҖ‘пјүгҖӮ
CYP3A4иҜұеҜјеүӮпјҡCYP3A4иҜұеҜјеүӮпјҢеҰӮеҲ©зҰҸе№іпјҢеҸҜйҷҚдҪҺиҲ’е°јжӣҝе°јзҡ„иЎҖжөҶжө“еәҰгҖӮе»әи®®йҖүжӢ©еҜ№жӯӨзұ»й…¶жІЎжңүжҲ–иҜұеҜјдҪңз”ЁжңҖе°Ҹзҡ„еҗҲ并用иҚҜгҖӮеҒҘеә·еҝ—ж„ҝиҖ…жңҚз”ЁеҚ•еүӮиҲ’е°јжӣҝе°јпјҢеҗҢж—¶з»ҷдәҲCYP3A4ејәиҜұеҜјеүӮпјҲеҲ©зҰҸе№іпјүпјҢеҸҜеҜјиҮҙжҖ»дҪ“пјҲиҲ’е°јжӣҝе°јеҸҠе…¶дё»иҰҒжҙ»жҖ§д»Ји°ўдә§зү©пјүзҡ„Cmaxе’ҢAUC0-вҲһеҲҶеҲ«йҷҚдҪҺ23%е’Ң46%гҖӮиҲ’е°јжӣҝе°јдёҺCYP3A4й…¶зі»иҜұеҜјеүӮпјҲдҫӢеҰӮпјҡең°еЎһзұіжқҫгҖҒиӢҜеҰҘиӢұгҖҒеҚЎй©¬иҘҝе№ігҖҒеҲ©зҰҸе№ігҖҒеҲ©зҰҸеёғжұҖгҖҒеҲ©зҰҸе–·жұҖгҖҒиӢҜе·ҙжҜ”еҰҘгҖҒеңЈзәҰзҝ°иҚүпјүеҗҢж—¶еә”з”Ёж—¶пјҢеҸҜйҷҚдҪҺиҲ’е°јжӣҝе°јжө“еәҰгҖӮеңЈзәҰзҝ°иҚүеҸҜиғҪдјҡзӘҒ然йҷҚдҪҺиҲ’е°јжӣҝе°јзҡ„иЎҖиҚҜжө“еәҰпјҢжӮЈиҖ…еңЁжҺҘеҸ—иҲ’е°јжӣҝе°јжІ»з–—ж—¶дёҚиғҪеҗҢж—¶жңҚз”ЁеңЈзәҰзҝ°иҚүгҖӮеҰӮжһңеҝ…йЎ»дёҺCYP3A4иҜұеҜјеүӮеҗҢж—¶еә”з”Ёж—¶пјҢйңҖиҰҒиҖғиҷ‘еўһеҠ жң¬е“ҒеүӮйҮҸпјҲи§ҒгҖҗз”ЁйҮҸе’Ңз”Ёжі•гҖ‘пјүгҖӮ
CYPжҠ‘еҲ¶е’ҢиҜұеҜјзҡ„дҪ“еӨ–з ”з©¶пјҡдҪ“еӨ–з ”з©¶з»“жһңиЎЁжҳҺиҲ’е°јжӣҝе°јдёҚдјҡиҜұеҜјжҲ–жҠ‘еҲ¶дё»иҰҒзҡ„CYPй…¶гҖӮеҜ№дәәиӮқеҫ®зІ’дҪ“е’ҢиӮқз»ҶиғһCYPдәҡеһӢпјҲCYP1A2гҖҒCYP2A6гҖҒCYP2B6гҖҒCYP2C8гҖҒCYP2C9гҖҒCYP2C19гҖҒCYP2D6гҖҒCYP2E1гҖҒCYP3A4/5е’ҢCYP4A9/11пјүзҡ„дҪ“еӨ–з ”з©¶иЎЁжҳҺиҲ’е°јжӣҝе°је’Ңе…¶дё»иҰҒжҙ»жҖ§д»Ји°ўзү©дёҚдјҡдёҺдҫқиө–иҝҷдәӣй…¶д»Ји°ўзҡ„иҚҜзү©еҸ‘з”ҹжңүдёҙеәҠж„Ҹд№үзҡ„зӣёдә’дҪңз”ЁгҖӮ
д№іи…әзҷҢиҖҗиҚҜзӣёе…іиӣӢзҷҪпјҲBCRPпјүжҠ‘еҲ¶еүӮпјҡжңүе…іиҲ’е°јжӣҝе°јдёҺBCRPжҠ‘еҲ¶еүӮзӣёдә’дҪңз”Ёзҡ„дёҙеәҠж•°жҚ®жңүйҷҗпјҢж— жі•жҺ’йҷӨиҲ’е°јжӣҝе°јдёҺе…¶д»–BCRPжҠ‘еҲ¶еүӮзӣёдә’дҪңз”Ёзҡ„еҸҜиғҪжҖ§пјҲи§ҒгҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘пјүгҖӮ
гҖҗиҚҜзү©иҝҮйҮҸгҖ‘
еӨ„зҗҶжң¬е“ҒиҚҜзү©иҝҮйҮҸзҡ„ж–№жі•еҢ…жӢ¬дёҖиҲ¬зҡ„ж”ҜжҢҒжҖ§жҺӘж–ҪгҖӮж— жІ»з–—жң¬е“ҒиҝҮйҮҸзҡ„зү№ж•Ҳи§ЈжҜ’еүӮгҖӮеҰӮжһңжңүдёҙеәҠжҢҮеҫҒж—¶пјҢеә”йҮҮз”ЁеӮ¬еҗҗжҲ–жҙ—иғғжё…йҷӨжңӘеҗёж”¶зҡ„иҚҜзү©гҖӮжӣҫжҠҘе‘Ҡж„ҸеӨ–зҡ„иҚҜзү©иҝҮйҮҸдәӢ件пјҢиҝҷдәӣз—…дҫӢжҲ–иҖ…дёҺиҲ’е°јжӣҝе°је·ІзҹҘзҡ„дёҚиүҜеҸҚеә”зӣёз¬ҰпјҢжҲ–иҖ…ж— дёҚиүҜеҸҚеә”гҖӮдёҖдҫӢдәәдёәзҡ„иҚҜзү©иҝҮйҮҸз”ұдәҺж‘„еҸ–иҲ’е°јжӣҝе°ј1500mgиҜ•еӣҫиҮӘжқҖеј•иө·пјҢдҪҶе№¶ж— дёҚиүҜеҸҚеә”гҖӮйқһдёҙеәҠз ”з©¶дёӯеңЁ500mg/kgпјҲ3000mg/m2пјү/ж—ҘпјҢжңҖе°‘з»ҷиҚҜ5еӨ©еҚіи§ӮеҜҹеҲ°еӨ§йј жӯ»дәЎгҖӮеңЁжӯӨеүӮйҮҸж°ҙе№іпјҢжҜ’жҖ§еҸҚеә”еҫҒиұЎеҢ…жӢ¬иӮҢиӮүеҚҸи°ғйҡңзўҚгҖҒж‘ҮеӨҙгҖҒжҙ»еҠЁеҮҸе°‘гҖҒзңјзқӣеҲҶжіҢзү©гҖҒз«–жҜӣе’ҢиғғиӮ йҒ“дёҚйҖӮгҖӮеңЁжӣҙдҪҺеүӮйҮҸж°ҙе№ідҪҶжӣҙй•ҝжІ»з–—жҢҒз»ӯж—¶й—ҙж—¶д№ҹи§ӮеҜҹеҲ°жӯ»дәЎеҸҠзӣёдјјзҡ„жҜ’жҖ§еҸҚеә”еҫҒиұЎгҖӮ
гҖҗдёҙеәҠиҜ•йӘҢгҖ‘
иҜҰи§ҒиҜҙжҳҺд№ҰвҖҰвҖҰ
гҖҗиҙ®и—ҸгҖ‘еҜҶе°ҒпјҢ30в„ғд»ҘдёӢдҝқеӯҳгҖӮ
гҖҗжңүж•ҲжңҹгҖ‘36дёӘжңҲ
гҖҗз”ҹдә§еҺӮе•ҶгҖ‘жӯЈеӨ§еӨ©жҷҙиҚҜдёҡйӣҶеӣўиӮЎд»Ҫжңүйҷҗе…¬еҸё
иӯҰе‘Ҡ:иӮқжҜ’жҖ§
еңЁдёҙеәҠз ”з©¶е’ҢдёҠеёӮеҗҺзҡ„дёҙеәҠеә”з”Ёдёӯи§ӮеҜҹеҲ°жӮЈиҖ…еҸ‘з”ҹиӮқжҜ’жҖ§еҸҚеә”пјҢиӮқжҜ’жҖ§еҸҜиғҪжҳҜйҮҚеәҰзҡ„пјҢжңүжҠҘе‘ҠиҮҙжӯ»з—…дҫӢгҖӮпјҲиҜҰи§ҒвҖңжіЁж„ҸдәӢйЎ№вҖқпјү














 е®ҳж–№еҫ®дҝЎ
е®ҳж–№еҫ®дҝЎ
 жүӢжңәе•ҶеҹҺ
жүӢжңәе•ҶеҹҺ