гҖҗе•Ҷе“ҒеҗҚз§°гҖ‘з•…жІӣпјҲChampixпјү
гҖҗдә§е“ҒеҗҚз§°з§°гҖ‘й…’зҹій…ёдјҗе°је…Ӣе…°зүҮ
гҖҗиӢұж–ҮеҗҚз§°гҖ‘Varenicline Tartrate Tablets
гҖҗжұүиҜӯжӢјйҹігҖ‘JiuShiSuanFaNiKeLanPian
гҖҗжҲҗд»ҪгҖ‘
жң¬е“Ғдё»иҰҒжҲҗд»Ҫдёәй…’зҹій…ёдјҗе°је…Ӣе…°гҖӮ
еҢ–еӯҰеҗҚз§°пјҡ7,8,9,10-еӣӣж°ў-6,10-дәҡз”Іеҹә-6H-еҗЎе—Әй…°иғә[2,3-h][3]иӢҜ并氮жқӮеҚ“-(2R,3R)-2,3-дәҢзҫҹеҹәдёҒдәҢй…ёзӣҗ(1:1)гҖӮ
гҖҗжҖ§ зҠ¶гҖ‘жң¬е“ҒдёәзҷҪиүІиҮізұ»зҷҪиүІи–„иҶңиЎЈзүҮпјҲ0.5mg и§„ж јпјүжҲ–ж·Ўи“қиүІи–„иҶңиЎЈзүҮпјҲ1.0mg и§„ж јпјүпјҢйҷӨеҺ»еҢ…иЎЈеҗҺжҳҫзҷҪиүІгҖӮ
гҖҗйҖӮеә”з—ҮгҖ‘жң¬е“ҒйҖӮз”ЁдәҺжҲҗдәәжҲ’зғҹгҖӮ
гҖҗз”Ёжі•з”ЁйҮҸгҖ‘
1гҖҒеүӮйҮҸпјҡ
жң¬е“Ғз”ЁдәҺеҸЈжңҚгҖӮйҰ–е…ҲжҢүеҰӮдёӢж–№жі•иҝӣиЎҢ1е‘Ёзҡ„еүӮйҮҸйҖ’еўһпјҢд№ӢеҗҺжҺЁиҚҗеүӮйҮҸдёәжҜҸж—Ҙ2ж¬ЎпјҢжҜҸж¬Ў1mgпјӣ
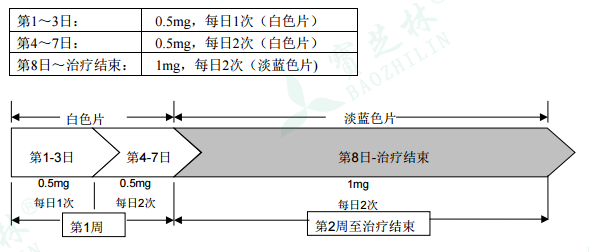
жӮЈиҖ…еә”и®ҫе®ҡжҲ’зғҹж—Ҙжңҹ并еңЁжӯӨж—ҘжңҹеүҚ1пҪһ2е‘ЁејҖе§ӢжңҚз”Ёжң¬е“ҒгҖӮ
еҜ№ж— жі•иҖҗеҸ—жң¬е“ҒдёҚиүҜеҸҚеә”зҡ„жӮЈиҖ…пјҢеҸҜжҡӮж—¶жҲ–й•ҝжңҹе°ҶеүӮйҮҸйҷҚиҮіжҜҸж—Ҙ2ж¬ЎпјҢжҜҸж¬Ў0.5mgгҖӮ
жӮЈиҖ…еә”жңҚз”Ёжң¬е“ҒжІ»з–—12е‘ЁгҖӮ
еҜ№дәҺз»Ҹ12е‘ЁжІ»з–—жҲ’зғҹжҲҗеҠҹзҡ„жӮЈиҖ…пјҢеҸҜиҖғиҷ‘з»ӯеҠ дёҖдёӘ12е‘Ёз–—зЁӢпјҢеүӮйҮҸд»ҚдёәжҜҸж—Ҙ2ж¬ЎпјҢжҜҸж¬Ў1mgгҖӮ
еҜ№дәҺйқһеёёеёҢжңӣжҲ’зғҹе’Ңз»Ҹе…ҲеүҚзҡ„жң¬е“ҒжІ»з–—жңӘжҲҗеҠҹжҲ’зғҹзҡ„жӮЈиҖ…пјҢжҲ–иҖ…жІ»з–—еҗҺеӨҚеҗёзҡ„жӮЈиҖ…пјҢеҶҚж¬Ўе°қиҜ•дҪҝз”Ёжң¬е“ҒжҲ’зғҹеҸҜиғҪиҺ·зӣҠпјҲи§ҒгҖҗдёҙеәҠиҜ•йӘҢгҖ‘пјүгҖӮ
еңЁжҲ’зғҹжІ»з–—дёӯпјҢеӨҚеҗёзҡ„йЈҺйҷ©еңЁзҙ§йҡҸжІ»з–—з»“жқҹзҡ„жңҹй—ҙеҶ…еҚҮй«ҳгҖӮеңЁеӯҳеңЁеӨҚеҗёй«ҳйЈҺйҷ©зҡ„жӮЈиҖ…дёӯпјҢеҸҜд»ҘиҖғиҷ‘иҚҜзү©йҖҗжёҗеҮҸйҮҸгҖӮжңүжҲ’зғҹж„Ҹж„ҝзҡ„жӮЈиҖ…е’ҢиҺ·еҫ—жӣҙеӨҡе»әи®®е’Ңж”ҜжҢҒзҡ„жӮЈиҖ…пјҢжҲ’зғҹжІ»з–—жӣҙжҳ“жҲҗеҠҹгҖӮ
2гҖҒиӮҫеҠҹиғҪжҚҹдјӨжӮЈиҖ…:
иҪ»(дј°жөӢиӮҢй…җжё…йҷӨзҺҮ>50ml/minдё”вүӨ80ml/min)иҮідёӯеәҰ(дј°жөӢиӮҢй…җжё…йҷӨзҺҮвүҘ30ml/minдё”вүӨ50ml/min)иӮҫеҠҹиғҪжҚҹдјӨжӮЈиҖ…пјҢдёҚйңҖи°ғж•ҙеүӮйҮҸгҖӮ
дёӯеәҰиӮҫеҠҹиғҪжҚҹдјӨдё”ж— жі•иҖҗеҸ—дёҚиүҜеҸҚеә”зҡ„жӮЈиҖ…пјҢеҸҜе°ҶеүӮйҮҸйҷҚиҮіжҜҸж—Ҙ1ж¬ЎпјҢжҜҸж¬Ў1mgгҖӮ
йҮҚеәҰиӮҫеҠҹиғҪжҚҹдјӨжӮЈиҖ…(дј°жөӢиӮҢй…җжё…йҷӨзҺҮ<30ml/min)пјҢжҺЁиҚҗеүӮйҮҸдёәжҜҸж—Ҙ1ж¬ЎпјҢжҜҸж¬Ў1mgгҖӮз»ҷиҚҜеүӮйҮҸеә”д»ҺжҜҸж—Ҙ1ж¬ЎпјҢжҜҸж¬Ў0.5mgејҖе§ӢпјҢ3еӨ©еҗҺеўһеҠ иҮіжҜҸж—Ҙ1ж¬ЎпјҢжҜҸж¬Ў1mgгҖӮжң¬е“ҒеҜ№дәҺз»Ҳжң«жңҹиӮҫз—…жӮЈиҖ…зҡ„дёҙеәҠз»ҸйӘҢжңүйҷҗпјҢеӣ жӯӨдёҚжҺЁиҚҗеңЁиҜҘдәәзҫӨдёӯеә”з”Ёжң¬е“Ғ(и§ҒгҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘)гҖӮ
3гҖҒиӮқеҠҹиғҪжҚҹдјӨжӮЈиҖ…пјҡ
иӮқеҠҹиғҪжҚҹдјӨжӮЈиҖ…дёҚйңҖи°ғж•ҙеүӮйҮҸ(и§ҒгҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘)гҖӮ
4гҖҒиҖҒе№ҙжӮЈиҖ…пјҡ
иҖҒе№ҙжӮЈиҖ…дёҚйңҖи°ғж•ҙеүӮйҮҸ(и§ҒгҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘)гҖӮеӣ иҖҒе№ҙжӮЈиҖ…жӣҙжҳ“еҸ‘з”ҹиӮҫеҠҹиғҪеҮҸйҖҖпјҢеӨ„ж–№еҢ»з”ҹеә”иҖғиҷ‘иҖҒе№ҙжӮЈиҖ…зҡ„иӮҫеҠҹиғҪзҠ¶еҶөгҖӮ
5гҖҒе„ҝз«ҘжӮЈиҖ…пјҡ
жң¬е“ҒеңЁе„ҝз«ҘжҲ–18еІҒд»ҘдёӢйқ’е°‘е№ҙдәәзҫӨдёӯзҡ„е®үе…ЁжҖ§еҸҠжңүж•ҲжҖ§е°ҡжңӘзЎ®е®ҡгҖӮзӣ®еүҚе·Іжңүж•°жҚ®и§ҒгҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘гҖӮе°ҡдёҚжҺЁиҚҗжң¬е“Ғеә”з”ЁдәҺиҜҘдәәзҫӨгҖӮ
6гҖҒжңҚз”Ёж–№жі•пјҡ
жң¬е“Ғеә”з”Ёж°ҙж•ҙзүҮеҗһжңҚпјҢйӨҗеүҚйӨҗеҗҺеқҮеҸҜжңҚз”ЁгҖӮ
В гҖҗдёҚиүҜеҸҚеә”гҖ‘
ж— и®әжҳҜеҗҰжҺҘеҸ—жҲ’зғҹжІ»з–—пјҢжҲ’зғҹжң¬иә«еҚідјҙйҡҸеӨҡз§Қз—ҮзҠ¶гҖӮдҫӢеҰӮжӣҫжңүжҠҘйҒ“иҜ•еӣҫжҲ’зғҹзҡ„жӮЈиҖ…еҮәзҺ°зғҰиәҒдёҚе®үгҖҒжҠ‘йғҒжғ…з»ӘгҖҒеӨұзң гҖҒжҳ“жҝҖжғ№гҖҒжҢ«жҠҳж„ҹгҖҒж„ӨжҖ’гҖҒз„Ұиҷ‘гҖҒжіЁж„ҸеҠӣж— жі•йӣҶдёӯгҖҒеқҗз«ӢдёҚе®үгҖҒеҝғзҺҮдёӢйҷҚгҖҒйЈҹж¬ІеўһеҠ жҲ–дҪ“йҮҚеўһеҠ зӯүгҖӮжң¬е“ҒдёҙеәҠз ”з©¶зҡ„и®ҫи®ЎеҸҠз»“жһңеҲҶжһҗдёӯжңӘеҜ№жүҖеҮәзҺ°зҡ„дёҚиүҜдәӢ件дёҺиҚҜзү©жҲ–е°јеҸӨдёҒжҲ’ж–ӯзӣёе…іжҖ§иҝӣиЎҢеҢәеҲҶгҖӮ
жң¬е“Ғзҡ„еӨҡйЎ№дёҙеәҠз ”з©¶ж¶үеҸҠзәҰ4,000еҗҚжӮЈиҖ…пјҢжІ»з–—ж—¶й—ҙжңҖй•ҝдёә1е№ҙ(е№іеқҮз»ҷиҚҜ84еӨ©)гҖӮеҰӮеҮәзҺ°дёҚиүҜеҸҚеә”пјҢйҖҡеёёеҸ‘з”ҹеңЁжІ»з–—зҡ„第дёҖе‘ЁпјҢдёҘйҮҚзЁӢеәҰеӨ§еӨҡдёәиҪ»иҮідёӯеәҰгҖӮдёҚеҗҢе№ҙйҫ„гҖҒз§Қж—ҸжҲ–жҖ§еҲ«зҡ„дёҚиүҜеҸҚеә”еҸ‘з”ҹзҺҮж— е·®ејӮгҖӮе®ҢжҲҗеҲқе§ӢеүӮйҮҸйҖ’еўһеҗҺпјҢжӮЈиҖ…жңҚз”ЁжҺЁиҚҗеүӮйҮҸжҜҸж—Ҙ2ж¬ЎпјҢжҜҸж¬Ў1mgгҖӮжҠҘе‘ҠжңҖеӨҡзҡ„дёҚиүҜдәӢ件дёәжҒ¶еҝғ (28.6%)гҖӮжҒ¶еҝғеӨҡж•°еҸ‘з”ҹеңЁжІ»з–—зҡ„ж—©жңҹпјҢдёҘйҮҚзЁӢеәҰдёәиҪ»иҮідёӯеәҰпјҢеҫҲе°‘еҜјиҮҙжІ»з–—зҡ„дёӯж–ӯгҖӮ
еӣ дёҚиүҜдәӢ件дёӯж–ӯжІ»з–—жӮЈиҖ…зҡ„жҜ”дҫӢпјҢжІ»з–—з»„дёә11.4%пјҢе®үж…°еүӮз»„дёә9.7%гҖӮеңЁиҝҷдәӣжӮЈиҖ…дёӯпјҢжІ»з–—з»„еёёи§ҒдёҚиүҜдәӢ件зҡ„жІ»з–—дёӯж–ӯзҺҮдёәпјҡжҒ¶еҝғ(2.7%пјҢе®үж…°еүӮз»„0.6%)гҖҒеӨҙз—ӣ(0.6%пјҢе®үж…°еүӮз»„1.0%)гҖҒеӨұзң (1.3%пјҢе®үж…°еүӮз»„1.2%)еҸҠжўҰеўғејӮеёё (0.2%пјҢе®үж…°еүӮз»„0.2%)гҖӮ
1гҖҒдёҚиүҜеҸҚеә”иЎЁ
дёӢиЎЁдёӯжүҖеҲ—дёәжІ»з–—з»„еҸ‘з”ҹзҺҮй«ҳдәҺе®үж…°еүӮз»„зҡ„дёҚиүҜеҸҚеә”пјҢеқҮжҢүз…§зі»з»ҹеҷЁе®ҳз§Қзұ»еҸҠеҸ‘з”ҹйў‘зҺҮжҺ’еҲ—пјҡеҫҲеёёи§Ғ(вүҘ1/10)пјҢеёёи§Ғ(вүҘ1/100иҮі<1/10)пјҢе°‘и§Ғ(вүҘ1/1,000иҮі<1/100)пјҢзҪ•и§Ғ(вүҘ1/10,000иҮі<1/1,000))гҖӮеҸ‘з”ҹйў‘зҺҮзұ»дјјзҡ„дёҚиүҜеҸҚеә”жҢүз”ұйҮҚиҮіиҪ»зҡ„йЎәеәҸжҺ’еҲ—гҖӮдёӢиЎЁеҲ—еҮәзҡ„жүҖжңүдёҚиүҜиҚҜзү©еҸҚеә”(ADR)пјҢд»ҘдёҠеёӮеүҚ2-3жңҹз ”з©¶ж•°жҚ®
зҡ„иҜ„дј°з»“жһңдёәдҫқжҚ®пјҢе№¶ж №жҚ®18йЎ№е®үж…°еүӮеҜ№з…§зҡ„дёҠеёӮеүҚе’ҢдёҠеёӮеҗҺз ”з©¶пјҲе…¶дёӯеҢ…жӢ¬еӨ§зәҰ5000еҗҚжҺҘеҸ—дјҗе°је…Ӣе…°жІ»з–—зҡ„жӮЈиҖ…пјүзҡ„жұҮжҖ»ж•°жҚ®иҝӣиЎҢжӣҙж–°гҖӮе·ІжҠҘе‘Ҡзҡ„дёҠеёӮеҗҺдёҚиүҜеҸҚеә”д№ҹеҢ…жӢ¬еңЁйў‘зҺҮжңӘзҹҘзҡ„пјҲдёҚиғҪд»ҺзҺ°жңүзҡ„ж•°жҚ®дј°и®ЎпјүгҖӮеңЁжҜҸдёӘйў‘зҺҮзҫӨдёӯпјҢдёҚиүҜеҸҚеә”жҢүз…§дёҘйҮҚжҖ§з”ұй«ҳеҲ°дҪҺзҡ„йЎәеәҸеҲ—еҮәгҖӮ

2гҖҒдёҠеёӮеҗҺз»ҸйӘҢпјҡ
еңЁжң¬е“ҒдёҠеёӮеҗҺдҪҝз”Ёжңҹй—ҙпјҢжңүдёӢиҝ°дёҚиүҜдәӢ件дёҠжҠҘгҖӮз”ұдәҺиҝҷдәӣдәӢ件жҳҜз”ұ规模дёҚзЎ®е®ҡзҡ„дәәзҫӨиҮӘеҸ‘дёҠжҠҘпјҢеӣ жӯӨж— жі•дј°и®ЎдәӢ件зҡ„еҸ‘з”ҹзҺҮжҲ–е»әз«Ӣе…¶дёҺиҚҜзү©д№Ӣй—ҙзҡ„еӣ жһңе…ізі»гҖӮ
еңЁжңҚз”Ёжң¬е“ҒиҝӣиЎҢжҲ’зғҹзҡ„жӮЈиҖ…дёӯпјҢдёҠжҠҘдәӢ件еҢ…жӢ¬жҠ‘йғҒгҖҒиәҒзӢӮгҖҒзІҫзҘһејӮеёёгҖҒе№»и§үгҖҒеҒҸжү§зӢӮгҖҒеҰ„жғігҖҒжқҖдәәж„ҸеҝөгҖҒж”»еҮ»жҖ§гҖҒж•Ңж„ҸгҖҒз„Ұиҷ‘е’ҢжғҠжҒҗпјҢд»ҘеҸҠиҮӘжқҖж„ҸеҝөгҖҒиҮӘжқҖдјҒеӣҫдёҺе®ҢжҲҗиҮӘжқҖпјҲи§ҒиӯҰзӨәиҜӯе’ҢгҖҗжіЁж„ҸдәӢйЎ№гҖ‘пјүгҖӮдёҚз®ЎжҳҜеҗҰйҮҮз”ЁиҚҜзү©жІ»з–—иҝӣиЎҢжҲ’зғҹпјҢжӮЈиҖ…йғҪеҸҜиғҪеҮәзҺ°е°јеҸӨдёҒжҲ’ж–ӯз—ҮзҠ¶пјҢеҸҠеҺҹжңүзІҫзҘһз–ҫз—…зҡ„еҠ йҮҚгҖӮ并йқһжүҖжңүжӮЈиҖ…йғҪдәҶи§Је…¶жҳҜеҗҰжӮЈжңүзІҫзҘһз–ҫз—…пјҢд№ҹ并дёҚжҳҜжүҖжңүжӮЈиҖ…йғҪдёҚеҶҚеҗёзғҹгҖӮ
жңҚз”Ёжң¬е“ҒиҝӣиЎҢжІ»з–—зҡ„жӮЈиҖ…дёӯжңүж–°еҸ‘зҷ«з—«жҲ–еҺҹжңүзҷ«з—«жҒ¶еҢ–зҡ„дёҠеёӮеҗҺжҠҘе‘ҠпјҲи§ҒиӯҰзӨәиҜӯе’ҢгҖҗжіЁж„ҸдәӢйЎ№гҖ‘пјүгҖӮ
жӮЈиҖ…еңЁжңҚз”Ёдјҗе°је…Ӣе…°жңҹй—ҙжңүй…’зІҫе…ҙеҘӢдҪңз”Ёеўһејәзҡ„дёҠеёӮеҗҺжҠҘе‘ҠгҖӮдёҖдәӣжӮЈиҖ…жҠҘе‘ҠдәҶзҘһз»ҸзІҫзҘһз—ҮзҠ¶пјҢеҢ…жӢ¬ејӮеёёиЎҢдёәе’Ңжңүж—¶еҸ‘з”ҹж”»еҮ»жҖ§иЎҢдёәпјҲи§ҒиӯҰзӨәиҜӯе’ҢгҖҗжіЁж„ҸдәӢйЎ№гҖ‘пјүгҖӮ
жңүжңҚз”Ёдјҗе°је…Ӣе…°жІ»з–—зҡ„жӮЈиҖ…еҮәзҺ°и¶…ж•ҸеҸҚеә”зҡ„дёҠеёӮеҗҺжҠҘе‘ҠпјҢеҢ…жӢ¬иЎҖз®ЎзҘһз»ҸжҖ§ж°ҙиӮҝпјҲи§ҒгҖҗжіЁж„ҸдәӢйЎ№гҖ‘пјүгҖӮ
жңүжңҚз”Ёдјҗе°је…Ӣе…°зҡ„жӮЈиҖ…еҮәзҺ°зҪ•и§ҒдҪҶдёҘйҮҚзҡ„зҡ®иӮӨеҸҚеә”зҡ„дёҠеёӮеҗҺжҠҘе‘ҠпјҢеҢ…жӢ¬ Stevens-Johnson з»јеҗҲеҫҒе’ҢеӨҡеҪўжҖ§зәўж–‘пјҲи§ҒгҖҗжіЁж„ҸдәӢйЎ№гҖ‘пјүгҖӮ
жңүжңҚз”Ёдјҗе°је…Ӣе…°жІ»з–—зҡ„жӮЈиҖ…еҮәзҺ°еҢ…жӢ¬зјәиЎҖжҖ§е’ҢеҮәиЎҖжҖ§дәӢ件еңЁеҶ…зҡ„еҝғиӮҢжў—жӯ»пјҲMIпјүе’Ңи„‘иЎҖз®Ўж„ҸеӨ–пјҲCVAпјүзҡ„дёҠеёӮеҗҺжҠҘе‘ҠгҖӮеңЁеӨ§еӨҡж•°жӯӨзұ»жҠҘе‘ҠдәӢ件дёӯпјҢжӮЈиҖ…йғҪжңүж—ўеҫҖзҡ„еҝғиЎҖз®Ўзі»з»ҹз–ҫз—…е’Ң/жҲ–е…¶д»–еҚұйҷ©еӣ зҙ гҖӮиҷҪ然еҗёзғҹжҳҜеј•иө·еҝғиӮҢжў—жӯ»е’Ңи„‘иЎҖз®Ўж„ҸеӨ–зҡ„еҚұйҷ©еӣ зҙ пјҢдҪҶжҳҜеҹәдәҺдјҗе°је…Ӣе…°зҡ„дҪҝз”Ёе’ҢдәӢ件д№Ӣй—ҙеӯҳеңЁж—¶й—ҙзӣёе…іжҖ§пјҢиҝҳдёҚиғҪжҺ’йҷӨдјҗе°је…Ӣе…°зҡ„еҸҜиғҪжҖ§гҖӮ
гҖҗзҰҒ еҝҢгҖ‘еҜ№жң¬е“Ғжҙ»жҖ§жҲҗд»ҪжҲ–д»»дҪ•иҫ…ж–ҷжҲҗд»ҪиҝҮж•ҸиҖ…гҖӮ
гҖҗжіЁж„ҸдәӢйЎ№гҖ‘
дёҖгҖҒиӯҰе‘Ҡ
1. зҘһз»ҸзІҫзҘһз—ҮзҠ¶е’ҢиҮӘжқҖ
еңЁжҺҘеҸ—жң¬е“ҒжІ»з–—зҡ„жӮЈиҖ…дёӯпјҢжңүжҠҘе‘ҠеҮәзҺ°дёҘйҮҚзҡ„зҘһз»ҸзІҫзҘһз—ҮзҠ¶пјҲи§ҒиӯҰзӨәиҜӯе’ҢгҖҗдёҚиүҜеҸҚеә”гҖ‘пјүгҖӮиҝҷдәӣдёҠеёӮеҗҺжҠҘе‘ҠеҢ…жӢ¬жғ…з»ӘеҸҳеҢ–пјҲеҢ…жӢ¬жҠ‘йғҒе’ҢиәҒзӢӮпјүгҖҒзІҫзҘһејӮеёёгҖҒе№»и§үгҖҒеҒҸжү§зӢӮгҖҒеҰ„жғігҖҒжқҖдәәж„ҸеҝөгҖҒж•Ңж„ҸгҖҒжҝҖи¶ҠгҖҒз„Ұиҷ‘е’ҢжғҠжҒҗпјҢд»ҘеҸҠиҮӘжқҖж„ҸеҝөгҖҒиҮӘжқҖдјҒеӣҫдёҺе®ҢжҲҗиҮӘжқҖгҖӮжҹҗдәӣжҠҘе‘ҠеҸҜиғҪдёҺеҒңжӯўеҗёзғҹзҡ„жӮЈиҖ…зҡ„е°јеҸӨдёҒжҲ’ж–ӯз—ҮзҠ¶йҡҫд»ҘеҢәеҲҶгҖӮжҠ‘йғҒжғ…з»ӘеҸҜиғҪжҳҜе°јеҸӨдёҒзҡ„жҲ’ж–ӯз—ҮзҠ¶пјҢеңЁиҝӣиЎҢйқһиҚҜзү©жҲ’зғҹзҡ„еҗёзғҹиҖ…дёӯе·Із»ҸжңүиҝҮдёҖдәӣжҠҘе‘ҠпјҢ并且еҒ¶жңүиҮӘжқҖжғіжі•зҡ„жҠҘе‘ҠгҖӮдёҚиҝҮпјҢжңҚз”Ёжң¬е“Ғ且继з»ӯеҗёзғҹзҡ„жӮЈиҖ…д№ҹжӣҫеҮәзҺ°дёҠиҝ°йғЁеҲҶз—ҮзҠ¶гҖӮиҝҷдәӣжҠҘе‘Ҡзҡ„з—ҮзҠ¶еӨҡеҸ‘з”ҹдәҺдҪҝз”Ёдјҗе°је…Ӣе…°жІ»з–—жңҹй—ҙпјҢдҪҶйғЁеҲҶд№ҹеҮәзҺ°еңЁеҒңжӯўжІ»з–—еҗҺгҖӮ
иҝҷдәӣдәӢ件еңЁд№ӢеүҚжӮЈжңүжҲ–жңӘжӮЈжңүзІҫзҘһз–ҫз—…зҡ„жӮЈиҖ…дёӯйғҪжӣҫеҮәзҺ°пјҢйғЁеҲҶжӮЈиҖ…зҡ„зІҫзҘһз–ҫз—…еҮәзҺ°жҒ¶еҢ–гҖӮжүҖжңүжӯЈеңЁжҺҘеҸ—жң¬е“ҒжІ»з–—зҡ„жӮЈиҖ…йғҪеә”жіЁж„Ҹи§ӮеҜҹжҳҜеҗҰеҮәзҺ°зҘһз»ҸзІҫзҘһз—ҮзҠ¶жҲ–еҺҹжңүзІҫзҘһз–ҫз—…зҡ„жҒ¶еҢ–гҖӮжӮЈжңүдёҘйҮҚзІҫзҘһз–ҫз—…зҡ„жӮЈиҖ…пјҢеҰӮзІҫзҘһеҲҶиЈӮз—ҮгҖҒеҸҢзӣёжғ…ж„ҹйҡңзўҚд»ҘеҸҠйҮҚжҖ§жҠ‘йғҒйҡңзўҚпјҢ并жңӘеҸӮеҠ дјҗе°је…Ӣе…°зҡ„дёҠеёӮеүҚз ”з©¶гҖӮй’ҲеҜ№д»ҘдёӢдёӨз»„жӮЈиҖ…зҡ„дёҠеёӮеҗҺжҲ’зғҹз ”з©¶еҸҜд»ҘиҺ·еҫ—жңүйҷҗзҡ„е®үе…ЁжҖ§ж•°жҚ®пјҡ1) йҮҚеәҰжҠ‘йғҒзҡ„жӮЈиҖ…пјҢд»ҘеҸҠ 2)зЁіе®ҡеһӢзІҫзҘһеҲҶиЈӮз—ҮжҲ–еҲҶиЈӮжғ…ж„ҹжҖ§йҡңзўҚпјҲи§ҒгҖҗдёҚиүҜеҸҚеә”гҖ‘пјүгҖӮ
жҠҘе‘Ҡзҡ„дёҖдәӣзҘһз»ҸзІҫзҘһз—ҮзҠ¶пјҲеҢ…жӢ¬ејӮеёёиЎҢдёәдё”жңүж—¶й’ҲеҜ№иҮӘе·ұжҲ–д»–дәәзҡ„ж”»еҮ»жҖ§иЎҢдёәпјүеҸҜиғҪеӣ 并用酒зІҫиҖҢжҒ¶еҢ–пјҲи§Ғ 3 дёҺй…’зІҫзҡ„зӣёдә’дҪңз”Ёе’ҢгҖҗдёҚиүҜеҸҚеә”гҖ‘пјүгҖӮ
е»әи®®жӮЈиҖ…еҸҠжҠӨзҗҶдәәе‘ҳпјҢеҪ“и§ӮеҜҹеҲ°жӮЈиҖ…еҮәзҺ°жҝҖи¶ҠгҖҒж•Ңж„ҸгҖҒжҠ‘йғҒжғ…з»ӘпјҢиЎҢдёәжҲ–жҖқз»ҙзӯүйқһиҮӘиә«е…ёеһӢжҖ§зҡ„ж”№еҸҳж—¶пјҢжҲ–жӮЈиҖ…дә§з”ҹиҮӘжқҖж„ҸеҝөжҲ–иҮӘжқҖиЎҢдёәж—¶пјҢжӮЈиҖ…еә”з«ӢеҚіеҒңжӯўжңҚз”Ёжң¬е“ҒпјҢ并иҒ”зі»еҢ»жҠӨдәәе‘ҳгҖӮеңЁеӨ§еӨҡж•°дёҠеёӮеҗҺжҠҘйҒ“з—…дҫӢдёӯпјҢжӮЈиҖ…еҒңжӯўжңҚз”Ёжң¬е“ҒеҗҺз—ҮзҠ¶ж¶ҲеӨұпјҢдҪҶеңЁжҹҗдәӣз—…дҫӢдёӯпјҢиҝҷдәӣз—ҮзҠ¶жҢҒз»ӯеӯҳеңЁгҖӮеӣ жӯӨпјҢеә”еҜ№жӮЈиҖ…иҝӣиЎҢжҢҒз»ӯзҡ„зӣ‘жөӢ并жҸҗдҫӣж”ҜжҢҒжІ»з–—пјҢзӣҙеҲ°з—ҮзҠ¶е®Ңе…Ёж¶ҲйҷӨгҖӮ
дјҗе°је…Ӣе…°зҡ„йЈҺйҷ©еә”дёҺе…¶з–—ж•ҲжқғиЎЎгҖӮз»ҸиҜҒжҳҺпјҢдёҺе®үж…°еүӮзӣёжҜ”пјҢдјҗе°је…Ӣе…°иғҪеӨҹжҸҗй«ҳй•ҝиҫҫдёҖе№ҙзҡ„жҲ’зғҹжҲҗеҠҹзҺҮгҖӮжҲ’зғҹзҡ„зӣҠеӨ„жҳҜз«ӢеҚізҡ„гҖҒжҳҫи‘—зҡ„гҖӮ
з”ұдәҺеҮәзҺ°дәҶзҘһз»ҸзІҫзҘһз—ҮзҠ¶е’ҢиҮӘжқҖзҡ„дҝЎеҸ·пјҢеӣ жӯӨиҝӣиЎҢдәҶжӣҙеӨҡеҲҶжһҗе’Ңз ”з©¶д»ҘиҝӣдёҖжӯҘиҜ„дј°е…¶зӣёе…іжҖ§гҖӮ
пјҲ1пјүдёҙеәҠз ”з©¶еҲҶжһҗ
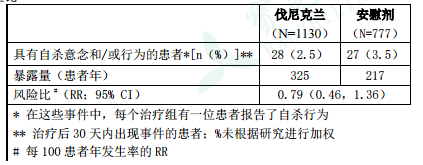
еҜ№еҢ…еҗ« 1907 дҪҚжӮЈиҖ…пјҲдјҗе°је…Ӣе…°з»„ 1130 дҪҚпјҢе®үж…°еүӮз»„ 777 дҪҚпјүзҡ„ 5 йЎ№йҡҸжңәгҖҒеҸҢзӣІгҖҒе®үж…°еүӮеҜ№з…§з ”
究иҝӣиЎҢдәҶиҚҹиҗғеҲҶжһҗпјҢйҮҮз”Ёе“ҘдјҰжҜ”дәҡиҮӘжқҖдёҘйҮҚзЁӢеәҰиҜ„еҲҶйҮҸиЎЁпјҲC-SSRSпјүиҜ„дј°иҮӘжқҖж„Ҹеҝөе’ҢиЎҢдёәгҖӮиҜҘиҚҹиҗғеҲҶ
жһҗеҢ…еҗ«дёҖйЎ№й’ҲеҜ№е…·жңүзІҫзҘһеҲҶиЈӮз—ҮжҲ–еҲҶиЈӮжғ…ж„ҹйҡңзўҚеҸІжӮЈиҖ…пјҲN=127пјүзҡ„з ”з©¶е’ҢеҸҰдёҖйЎ№й’ҲеҜ№е…·жңүжҠ‘йғҒеҸІжӮЈиҖ…
пјҲN=525пјүзҡ„з ”з©¶гҖӮз»“жһңиЎЁжҳҺпјҢдҪҝз”Ёдјҗе°је…Ӣе…°жІ»з–—зҡ„жӮЈиҖ…иҮӘжқҖж„Ҹеҝөе’Ң/жҲ–иЎҢдёәзҡ„еҸ‘з”ҹзҺҮдёҺдҪҝз”Ёе®үж…°еүӮзҡ„
жӮЈиҖ…зӣёжҜ”жңӘеўһеҠ пјҢйЈҺйҷ©жҜ”пјҲRRпјүдёә 0.79пјҲ95%еҸҜдҝЎеҢәй—ҙ[CI]пјҡ0.46пјҢ1.36пјүпјҢеҰӮиЎЁ 1 жүҖзӨәгҖӮжҠҘе‘ҠжңүиҮӘжқҖж„ҸеҝөжҲ–иЎҢдёәзҡ„ 55 дҪҚжӮЈиҖ…дёӯпјҢжңү 48 дҪҚпјҲдјҗе°је…Ӣе…°з»„ 24 дҪҚпјҢе®үж…°еүӮз»„ 24 дҪҚпјүжқҘиҮӘеҢ…еҗ«е…·жңүзІҫзҘһеҲҶиЈӮз—ҮгҖҒеҲҶиЈӮжғ…ж„ҹйҡңзўҚжҲ–жҠ‘йғҒз—…еҸІжӮЈиҖ…зҡ„дёӨйЎ№иҜ•йӘҢгҖӮе…¶д»–дёүйЎ№иҜ•йӘҢдёӯи§ӮеҜҹеҲ°зҡ„дәӢ件иҫғе°‘пјҲдјҗе°је…Ӣе…°з»„ 4 дҪҚпјҢе®үж…°еүӮз»„ 3 дҪҚпјүгҖӮ
иЎЁ1. 5йЎ№жҜ”иҫғдјҗе°је…Ӣе…°е’Ңе®үж…°еүӮзҡ„дёҙеәҠз ”з©¶зҡ„иҚҹиҗғеҲҶжһҗдёӯпјҢз»ҸC-SSRSиҜ„дј°еҫ—еҮәиҮӘжқҖж„Ҹеҝөе’Ң/жҲ–иЎҢдёәзҡ„жӮЈиҖ…дәәж•°е’ҢйЈҺйҷ©жҜ”
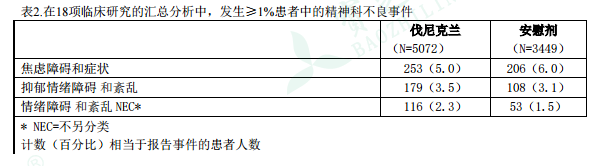
еҜ№ 18 йЎ№еҸҢзӣІгҖҒйҡҸжңәгҖҒе®үж…°еүӮеҜ№з…§зҡ„дёҙеәҠз ”з©¶пјҲеҢ…жӢ¬иЎЁ 1 дёӯжүҖиҝ°зҡ„收йӣҶдәҶ C-SSRS зҡ„ 5 йЎ№з ”з©¶пјүиҝӣиЎҢдәҶжұҮжҖ»еҲҶжһҗпјҢд»ҘиҜ„дј°дјҗе°је…Ӣе…°зҡ„зІҫзҘһ科е®үе…ЁжҖ§гҖӮиҜҘжұҮжҖ»еҲҶжһҗеҢ…жӢ¬ 8521 дҪҚжӮЈиҖ…пјҲдјҗе°је…Ӣе…°з»„ 5072 дҪҚпјҢе®үж…°еүӮз»„ 3449 дҪҚпјүпјҢе…¶дёӯдёҖдәӣжӮЈиҖ…еҹәзәҝж—¶жӮЈжңүзІҫзҘһз–ҫз—…гҖӮиЎЁ 2 жҸҸиҝ°дәҶжңҖеёёжҠҘе‘ҠпјҲвүҘ1%пјүзҡ„дёҺзІҫзҘһ科е®үе…ЁжҖ§жңүе…ізҡ„дёҚиүҜдәӢ件гҖӮз»“жһңиЎЁжҳҺпјҢдјҗе°је…Ӣе…°е’Ңе®үж…°еүӮжІ»з–—з»„жӮЈиҖ…зҡ„еёёи§ҒзІҫзҘһдәӢ件еҸ‘з”ҹзҺҮзӣёдјјгҖӮ
иЎЁ2.еңЁ18йЎ№дёҙеәҠз ”з©¶зҡ„жұҮжҖ»еҲҶжһҗдёӯпјҢеҸ‘з”ҹвүҘ1%жӮЈиҖ…дёӯзҡ„зІҫзҘһ科дёҚиүҜдәӢ件
пјҲ2пјүи§ӮеҜҹжҖ§з ”究
еӣӣйЎ№и§ӮеҜҹжҖ§з ”究пјҢжҜҸйЎ№з ”з©¶еҢ…еҗ«з»Ҹи°ғж•ҙеҲҶжһҗзҡ„10,000иҮі30,000дҪҚдјҗе°је…Ӣе…°дҪҝз”ЁиҖ…пјҢжҜ”иҫғдәҶдјҗе°је…Ӣе…°дҪҝз”ЁиҖ…дёҺеӨ„ж–№NRTжҲ–е®үйқһд»–й…®дҪҝз”ЁиҖ…д№Ӣй—ҙйҖүе®ҡзҡ„дёҘйҮҚзҘһз»ҸзІҫзҘһз—ҮзҠ¶пјҲеӣ зҘһз»ҸзІҫзҘһз–ҫз—…дҪҸйҷўжІ»з–—гҖҒиҮҙе‘Ҫе’ҢйқһиҮҙе‘Ҫзҡ„иҮӘжҲ‘дјӨе®іпјүйЈҺйҷ©гҖӮжүҖжңүз ”з©¶йғҪжҳҜеӣһйЎҫжҖ§йҳҹеҲ—з ”з©¶пјҢзәіе…ҘдәҶе…·жңүе’ҢдёҚе…·зІҫзҘһз—…еҸІзҡ„жӮЈиҖ…гҖӮ
е…¶дёӯдёӨйЎ№з ”з©¶еҸ‘зҺ°пјҢдјҗе°је…Ӣе…°дҪҝз”ЁиҖ…дёҺе°јеҸӨдёҒиҙҙзүҮдҪҝз”ЁиҖ…д№Ӣй—ҙеӣ зҘһз»ҸзІҫзҘһжҖ§з–ҫз—…дҪҸйҷўжІ»з–—зҡ„йЈҺйҷ©ж— е·®ејӮпјҲ第дёҖйЎ№з ”з©¶зҡ„еҚұйҷ©жҜ”[HR]дёә1.14пјӣ95%еҸҜдҝЎеҢәй—ҙ[CI]пјҡ0.56вҖ“2.34пјӣ第дәҢйЎ№з ”з©¶зҡ„еҚұйҷ©жҜ”дёә0.76пјӣ95% CIпјҡ0.40-1.46пјүгҖӮдҪҶжҳҜпјҢдёӨйЎ№з ”з©¶еқҮжңӘйӘҢиҜҒз”ЁдәҺж №жҚ®з—…еҺҶзЎ®е®ҡз»“жһңзҡ„иҜҠж–ӯд»Јз ҒгҖӮ第дёүйЎ№з ”з©¶жҠҘе‘ҠпјҢеңЁжҖҘиҜҠе°ұиҜҠжҲ–дҪҸйҷўжңҹй—ҙиҜҠж–ӯеҮәзІҫзҘһ科дёҚиүҜдәӢ件зҡ„йЈҺйҷ©ж–№йқўпјҢдјҗе°је…Ӣе…°дҪҝз”ЁиҖ…е’Ңе®үйқһд»–й…®дҪҝз”ЁиҖ…д№Ӣй—ҙж— е·®ејӮпјҲHR 0.85пјӣ95% CIпјҡ0.55-1.30пјүгҖӮе®үйқһд»–й…®д№ҹдёҺзҘһз»ҸзІҫзҘһжҖ§дёҚиүҜдәӢ件жңүе…ігҖӮ第еӣӣйЎ№з ”з©¶жЈҖжҹҘдәҶдјҗе°је…Ӣе…°дҪҝз”ЁиҖ…дёҺNRTдҪҝз”ЁиҖ…зӣёжҜ”зҡ„иҮҙжӯ»жҖ§е’ҢйқһиҮҙжӯ»жҖ§иҮӘжҲ‘дјӨе®ізҡ„йЈҺйҷ©гҖӮиҷҪ然еңЁжӮЈиҖ…ејҖе§Ӣд»»дҪ•иҚҜзү©жІ»з–—еҗҺдёүдёӘжңҲжңҹй—ҙеҸ‘з”ҹзҡ„еҸҜеҸ‘зҺ°зҡ„иҮӘжқҖиҫғзҪ•и§ҒпјҲ31,260дҪҚдјҗе°је…Ӣе…°дҪҝз”ЁиҖ…дёӯжңүдёӨдҫӢпјҢ81,545дҪҚNRTдҪҝз”ЁиҖ…дёӯжңүе…ӯдҫӢпјүпјҢиҜҘз ”з©¶д№ҹеӯҳеңЁдёҘйҮҚеұҖйҷҗжҖ§гҖӮжңҖйҮҚиҰҒзҡ„жҳҜпјҢиҝҷдәӣж•°жҚ®жҳҜеңЁе…¬дј—зҹҘжҷ“дјҗе°је…Ӣе…°дҪҝз”ЁиҖ…зҡ„зҘһз»ҸзІҫ
зҘһжҖ§дёҚиүҜдәӢ件жҠҘе‘ҠеҗҺ收йӣҶзҡ„гҖӮдјҗе°је…Ӣе…°дҪҝз”ЁиҖ…еҮәзҺ°еҸҜиғҪдҪҝе…¶еӨ„дәҺзҘһз»ҸзІҫзҘһдёҚиүҜдәӢ件йЈҺйҷ©дёӯзҡ„еҗҲ并жғ…еҶөиҫғе°‘пјҢиҝҷиЎЁжҳҺе…·жңүзҘһз»ҸзІҫзҘһз—…еҸІзҡ„жӮЈиҖ…дјҳе…ҲеӨ„ж–№NRTпјҢжӣҙеҒҘеә·зҡ„жӮЈиҖ…дјҳе…ҲеӨ„ж–№дјҗе°је…Ӣе…°гҖӮ
иҝҷдәӣз ”з©¶дёӯжЈҖжҹҘзҡ„з»“жһңдёҚеҢ…жӢ¬е·ІжҠҘе‘Ҡзҡ„е…ЁйғЁзҘһз»ҸзІҫзҘһдёҚиүҜдәӢ件гҖӮ
2гҖҒзҷ«з—«
еңЁдёҙеәҠз ”з©¶е’ҢдёҠеёӮеҗҺз»ҸйӘҢдёӯпјҢе·ІжңүдҪҝз”Ёдјҗе°је…Ӣе…°жІ»з–—зҡ„жӮЈиҖ…еҸ‘з”ҹзҷ«з—«зҡ„жҠҘе‘ҠгҖӮдёҖдәӣжӮЈиҖ…жІЎжңүзҷ«з—«з—…еҸІпјҢиҖҢеҸҰдёҖдәӣжӮЈиҖ…зҡ„зҷ«з—«з—…еҸІеҲҷе…·жңүиҝңжңҹжҖ§жҲ–еҫ—еҲ°иүҜеҘҪжҺ§еҲ¶гҖӮеңЁеӨ§еӨҡж•°з—…дҫӢдёӯпјҢзҷ«з—«еҸ‘з”ҹеңЁжІ»з–—зҡ„第дёҖжңҲеҶ…гҖӮеңЁеҜ№жңүзҷ«з—«з—…еҸІжҲ–еӯҳеңЁе…¶д»–еҸҜиғҪйҷҚдҪҺзҷ«з—«еҸ‘дҪңйҳҲеҖјеӣ зҙ зҡ„жӮЈиҖ…еӨ„ж–№дјҗе°је…Ӣе…°д№ӢеүҚпјҢеә”жқғиЎЎиҜҘжҪңеңЁйЈҺйҷ©еҸҠ收зӣҠгҖӮеҰӮжһңжІ»з–—жңҹй—ҙеҮәзҺ°зҷ«з—«еҸ‘дҪңпјҢе»әи®®жӮЈиҖ…еҒңз”Ёдјҗе°је…Ӣ兰并з«ӢеҚіиҒ”зі»еҢ»жҠӨдәәе‘ҳпјҲи§ҒгҖҗдёҚиүҜеҸҚеә”гҖ‘пјүгҖӮ
3гҖҒдёҺй…’зІҫзҡ„зӣёдә’дҪңз”Ё
е·ІжңүжӮЈиҖ…еңЁжңҚз”Ёдјҗе°је…Ӣе…°жңҹй—ҙй…’зІҫе…ҙеҘӢдҪңз”Ёеўһејәзҡ„дёҠеёӮеҗҺжҠҘе‘ҠгҖӮдёҖдәӣз—…дҫӢжҸҸиҝ°дәҶејӮеёёиЎҢдёәе’Ңжңүж—¶ж”»еҮ»жҖ§иЎҢдёәпјҢдё”дәӢ件常дјҙйҡҸеӨұеҝҶгҖӮеңЁжңҚз”Ёдјҗе°је…Ӣе…°жңҹй—ҙпјҢе»әи®®жӮЈиҖ…еңЁдёҚзҹҘжҷ“дјҗе°је…Ӣе…°жҳҜеҗҰдјҡеҜ№д»–们зҡ„й…’зІҫиҖҗеҸ—жҖ§дә§з”ҹеҪұе“Қзҡ„жғ…еҶөдёӢеҮҸе°‘й…’зІҫйҘ®з”ЁйҮҸпјҲи§ҒгҖҗдёҚиүҜеҸҚеә”гҖ‘пјүгҖӮ
4гҖҒж„ҸеӨ–дјӨе®і
еңЁжңҚз”Ёжң¬е“Ғзҡ„жӮЈиҖ…дёӯпјҢжңүе…ідәҺдәӨйҖҡдәӢж•…гҖҒжңӘйҒӮдәӨйҖҡдәӢж•…жҲ–е…¶д»–ж„ҸеӨ–дјӨе®ізҡ„дёҠеёӮеҗҺжҠҘе‘ҠгҖӮеңЁжңүдәӣз—…дҫӢдёӯжӮЈиҖ…жҠҘе‘ҠеңЁй©ҫ驶жҲ–ж“ҚдҪңжңәеҷЁжңҹй—ҙеҮәзҺ°е—ңзқЎгҖҒеӨҙжҷ•гҖҒж„ҸиҜҶдё§еӨұжҲ–жіЁж„ҸеҠӣйҡҫд»ҘйӣҶдёӯпјҢд»ҺиҖҢеҜјиҮҙжҚҹдјӨжҲ–еј•иө·еҸҜиғҪйҖ жҲҗжҚҹдјӨзҡ„жӢ…еҝғгҖӮеә”е»әи®®жӮЈиҖ…пјҢеңЁжңӘдәҶи§ЈжңҚз”Ёжң¬е“ҒеҸҜиғҪдјҡеҜ№д»–们дә§з”ҹд»Җд№Ҳж ·зҡ„еҪұе“Қзҡ„жғ…еҶөдёӢпјҢеә”и°Ёж…Һд»ҺдәӢй©ҫ驶гҖҒж“ҚдҪңжңәеҷЁжҲ–е…¶е®ғе…·жңүжҪңеңЁеҚұйҷ©зҡ„жҙ»еҠЁгҖӮ
5гҖҒеҝғиЎҖз®ЎдәӢ件
жң¬е“ҒеңЁзЁіе®ҡеһӢеҝғиЎҖз®Ўз–ҫз—…жӮЈиҖ…дёӯиҝӣиЎҢдәҶе®үж…°еүӮеҜ№з…§дёҙеәҠз ”з©¶пјҢжҜҸжІ»з–—з»„зәҰ350еҗҚжӮЈиҖ…пјҢеңЁз ”究дёӯдјҗе°је…Ӣе…°жІ»з–—з»„дёӯе…Ёеӣ е’ҢеҝғиЎҖз®Ўжӯ»дәЎзҺҮдҪҺдәҺе®үж…°еүӮз»„пјҢдҪҶжҹҗдәӣйқһжӯ»жҖ§еҝғиЎҖз®ЎдәӢ件зҡ„еҸ‘з”ҹзҺҮй«ҳдәҺе®үж…°еүӮз»„пјҲи§ҒгҖҗдёҙеәҠиҜ•йӘҢгҖ‘пјүгҖӮдёӢиЎЁжҳҫзӨәдәҶй«ҳдәҺе®үж…°еүӮз»„зҡ„пјҢдјҗе°је…Ӣе…°з»„жӯ»дәЎдәӢ件е’ҢйҖүжӢ©жҖ§йқһиҮҙжӯ»жҖ§дёҘйҮҚеҝғиЎҖз®ЎдәӢ件зҡ„еҸ‘з”ҹзҺҮгҖӮиҝҷдәӣдәӢ件з”ұзӢ¬з«Ӣзҡ„зӣІжҖҒ委е‘ҳдјҡиҝӣиЎҢеҲӨе®ҡгҖӮдёӨз»„еҸ‘з”ҹзҺҮзӣёдјјжҲ–е®үж…°еүӮз»„жӣҙеёёи§Ғзҡ„йқһиҮҙжӯ»жҖ§дёҘйҮҚеҝғиЎҖз®ЎдәӢ件зҡ„еҸ‘з”ҹзҺҮжңӘеҲ—е…ҘгҖӮеңЁжҜҸиЎҢдёӯпјҢеҮәзҺ°еӨҡж¬ЎзӣёеҗҢеҝғиЎҖз®ЎдәӢ件зҡ„жӮЈиҖ…йғҪд»…и®°еҪ•1ж¬ЎгҖӮдёҖдәӣйңҖиҰҒеҶ зҠ¶еҠЁи„үйҮҚе»әжңҜзҡ„жӮЈиҖ…жүҖиҝӣиЎҢзҡ„жҺӘж–ҪдҪңдёәйқһиҮҙжӯ»жҖ§еҝғиӮҢжў—жӯ»е’Ңеӣ еҝғз»һз—ӣдҪҸйҷўжІ»з–—зҡ„дёҖйғЁеҲҶгҖӮ
иЎЁ3дёҺе®үж…°еүӮеҜ№з…§зҡ„й…’зҹій…ёдјҗе°је…Ӣе…°зүҮеңЁзЁіе®ҡжҖ§еҶ еҝғз—…жӮЈиҖ…дёӯзҡ„дёҙеәҠз ”з©¶дёӯжӯ»дәЎзҺҮе’ҢеҲӨе®ҡзҡ„йқһиҮҙжӯ»жҖ§дёҘйҮҚеҝғиЎҖз®ЎдәӢ件
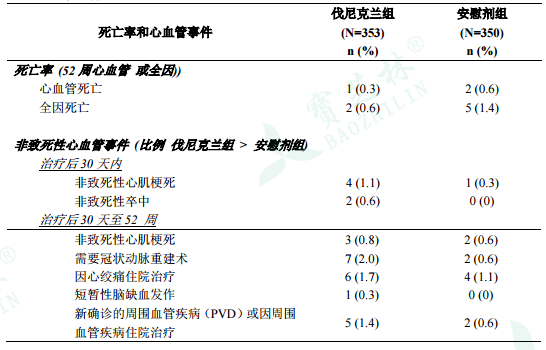
дёҖйЎ№еҢ…жӢ¬15дёӘдёҙеәҠиҜ•йӘҢгҖҒжІ»з–—ж—¶й—ҙвүҘ12е‘ЁгҖҒжҖ»и®Ў7002дҫӢжӮЈиҖ…пјҲдјҗе°је…Ӣе…°з»„4190дҫӢгҖҒе®үж…°еүӮз»„2812дҫӢпјүзҡ„иҚҹиҗғеҲҶжһҗеҜ№й…’зҹій…ёдјҗе°је…Ӣе…°зҡ„еҝғиЎҖз®Ўе®үе…ЁжҖ§иҝӣиЎҢдәҶзі»з»ҹжҖ§иҜ„д»·гҖӮдёҠиҝ°еңЁзЁіе®ҡеһӢеҝғиЎҖз®Ўз–ҫз—…жӮЈиҖ…дёӯиҝӣиЎҢзҡ„дёҙеәҠз ”з©¶зәіе…ҘиҜҘиҚҹиҗғеҲҶжһҗдёӯгҖӮиҚҹиҗғеҲҶжһҗз»“жһңдёӯпјҢдјҗе°је…Ӣе…°з»„зҡ„е…Ёеӣ жӯ»дәЎпјҲдјҗе°је…Ӣе…°з»„6дҫӢ[0.14%]пјҢе®үж…°еүӮз»„7дҫӢ[0.25%]пјүе’ҢеҝғиЎҖз®Ўжӯ»дәЎпјҲдјҗе°је…Ӣе…°з»„2дҫӢ[0.05%]пјҢе®үж…°еүӮз»„2дҫӢ[0.07%]пјүеҸ‘з”ҹжҜ”дҫӢдҪҺдәҺе®үж…°еүӮз»„гҖӮ
е…ій”®зҡ„еҝғиЎҖз®Ўе®үе…ЁжҖ§еҲҶжһҗеҢ…жӢ¬дё»иҰҒеҝғиЎҖз®ЎдёҚиүҜдәӢ件пјҲMACEпјүзҡ„еӨҚеҗҲз»ҲзӮ№зҡ„еҸ‘з”ҹе’Ңж—¶й—ҙгҖӮMACEе®ҡд№үдёәеҝғиЎҖз®Ўжӯ»дәЎгҖҒйқһиҮҙжӯ»жҖ§еҝғиӮҢжў—жӯ»е’ҢйқһиҮҙжӯ»жҖ§еҚ’дёӯгҖӮеҢ…жӢ¬еңЁз»ҲзӮ№дёӯзҡ„иҝҷдәӣдәӢ件з”ұзӢ¬з«Ӣзҡ„зӣІжҖҒ委е‘ҳдјҡиҝӣиЎҢеҲӨе®ҡгҖӮжҖ»зҡ„жқҘиҜҙпјҢиҚҹиҗғеҲҶжһҗдёӯеҢ…жӢ¬зҡ„дёҙеәҠиҜ•йӘҢдёӯMACEеҸ‘з”ҹиҫғе°‘пјҢе…·дҪ“ж•°жҚ®и§ҒдёӢиЎЁгҖӮиҝҷдәӣдәӢ件主иҰҒеҸ‘з”ҹеңЁе·ІзҹҘжӮЈжңүеҝғиЎҖз®Ўз–ҫз—…зҡ„жӮЈиҖ…дёӯгҖӮ
![яъiЧъiюҡuюҡҰқҝҰ”ӯzч§°ҡ!һК'юҡwюҡuҡ
фЧM9ҡ
zЧ]vЦh7юҡxюҡuя]4Уi ЯъiЦh5ҡ
жғъiюҡuюҡҰқҝҰҹй§й§ъiюҡҰҹй§ъiюҡOгқ5Рю9УъiюҡҰқҪюҡҰ’
GъiюҡҰҹйӨФS5�хЫnҰҳx
E?й§ъiюҡҰҹй§ъiюҡuюҡxЫҚҝҰһ6гn6ЯҺtУҪщУMvУM4ЫM4з‘УЬЁ·зIМюҡvюҡuюҡ@ҷл��пЗ�фSюҡvюҡR�^fғщ ь��Цh6�Җъп~өжh?’�АP-fҖ��Яӯжғщ ь��Цh� ?ҰқyЯI юH?�@өҡ�H�~№У}&ғщ ь��Цh� >tЧI юH?�@өҡ�H�mхжh?’�АP-fҖ��ЯҜй§йӨ хЫI юH?�@ёпfЎӯз](http://img.360bzl.com/images/upload/Image/01001040-1056.PNG) иӮҝзҳӨеҸ‘з”ҹзҺҮеўһеҠ гҖӮ
иӮҝзҳӨеҸ‘з”ҹзҺҮеўһеҠ гҖӮ
SD еӨ§йј з»ҸеҸЈз»ҷдәҲдјҗе°је…Ӣе…°еүӮйҮҸдёә 1гҖҒ5гҖҒ15 mg/kg/еӨ©иҝһз»ӯ 2 е№ҙгҖӮеңЁйӣ„жҖ§еӨ§йј пјҲn = 65 еҸӘ/жҖ§еҲ«/еүӮйҮҸз»„пјүдёӯпјҢеҸҜи§ҒдёӯгҖҒй«ҳеүӮйҮҸз»„еҶ¬зң зҳӨеҸ‘з”ҹзҺҮеўһеҠ пјҲдёӯеүӮйҮҸ 5mg/kg/еӨ©ж №жҚ® AUC зәҰдёәдәәжңҖеӨ§жҺЁиҚҗж—ҘжҡҙйңІйҮҸзҡ„ 23 еҖҚпјҢ1 дҫӢпјӣй«ҳеүӮйҮҸ 15 mg/kg/еӨ©ж №жҚ® AUC зәҰдёәдәәжңҖеӨ§жҺЁиҚҗж—ҘжҡҙйңІйҮҸзҡ„ 67 еҖҚпјҢ2 дҫӢпјүгҖӮе°ҡжңӘзЎ®з«ӢиҜҘеҸ‘зҺ°дёҺдәәдҪ“зҡ„дёҙеәҠзӣёе…іжҖ§гҖӮйӣҢжҖ§еӨ§йј жңӘи§ҒиӮҝзҳӨеҸ‘з”ҹзҺҮеўһеҠ гҖӮ
гҖҗиҚҜд»ЈеҠЁеҠӣеӯҰгҖ‘
1гҖҒеҗёж”¶пјҡдјҗе°је…Ӣе…°дёҖиҲ¬еңЁеҸЈжңҚз»ҷиҚҜеҗҺ3пҪһ4е°Ҹж—¶иҫҫеҲ°иЎҖжөҶеі°жө“еәҰгҖӮеҒҘеә·еҝ—ж„ҝиҖ…еӨҡж¬ЎеҸЈжңҚз»ҷиҚҜеҗҺпјҢиЎҖиҚҜжө“еәҰеҸҜеңЁ4еӨ©еҶ…иҫҫеҲ°зЁіжҖҒгҖӮеҸЈжңҚз»ҷиҚҜеҗёж”¶е®Ңе…ЁпјҢзі»з»ҹз”ҹзү©еҲ©з”ЁеәҰй«ҳгҖӮдјҗе°је…Ӣе…°еҸЈжңҚз”ҹзү©еҲ©з”ЁеәҰдёҚеҸ—йЈҹзү©е’Ңз»ҷиҚҜж—¶й—ҙзҡ„еҪұе“ҚгҖӮ
2гҖҒеҲҶеёғпјҡдјҗе°је…Ӣе…°еҲҶеёғдәҺеҢ…жӢ¬и„‘з»„з»Үзҡ„еҗ„з§Қз»„з»ҮдёӯгҖӮзЁіжҖҒиЎЁи§ӮеҲҶеёғе®№з§Ҝе№іеқҮдёә415еҚҮ(%CV=50)гҖӮдјҗе°је…Ӣе…°иЎҖжөҶиӣӢзҷҪз»“еҗҲзҺҮдҪҺ(вүӨ20%)пјҢдё”дёҺе№ҙйҫ„еҸҠиӮҫеҠҹиғҪж— е…ігҖӮеңЁе•®йҪҝеҠЁзү©пјҢдјҗе°је…Ӣе…°иғҪйҖҡиҝҮиғҺзӣҳ并еңЁд№іжұҒдёӯеҲҶжіҢгҖӮ
3гҖҒз”ҹзү©иҪ¬еҢ–пјҡ
дјҗе°је…Ӣе…°д»Ји°ўзҺҮеҫҲдҪҺпјҢ92%д»ҘеҺҹеҪўиҚҜзү©з»Ҹе°ҝжҺ’еҮәпјҢдёҚи¶і10%д»Ҙд»Ји°ўдә§зү©жҺ’еҮәгҖӮе°ҝдёӯзҡ„е°‘йҮҸд»Ји°ўдә§зү©еҢ…жӢ¬дјҗе°је…Ӣе…°-N-ж°Ёеҹәз”Ій…°и‘Ўиҗ„зі–иӢ·й…ёеҸҠзҫҹеҹәдјҗе°је…Ӣе…°гҖӮдҪ“еҫӘзҺҜдёӯдёҺдјҗе°је…Ӣе…°зӣёе…ізҡ„зү©иҙЁ91%дёәеҺҹеҪўиҚҜзү©гҖӮдҪ“еҫӘзҺҜдёӯзҡ„е°‘йҮҸд»Ји°ўдә§зү©еҢ…жӢ¬дјҗе°је…Ӣе…°-N-ж°Ёеҹәз”Ій…°и‘Ўиҗ„зі–иӢ·й…ёеҸҠN-иҪ¬и‘Ўзі–еҹәдјҗе°је…Ӣе…°гҖӮ
дҪ“еӨ–з ”з©¶жҳҫзӨәдјҗе°је…Ӣе…°дёҚжҠ‘еҲ¶з»ҶиғһиүІзҙ P450й…¶(IC50>6,400ng/ml)гҖӮз»ҸжҠ‘еҲ¶е®һйӘҢжЈҖжөӢзҡ„P450й…¶еҢ…жӢ¬пјҡ1A2пјҢ2A6пјҢ2B6пјҢ2C8пјҢ2C9пјҢ2C19пјҢ2D6пјҢ2E1еҸҠ3A4/5гҖӮз ”з©¶дәҰжҳҫзӨәпјҢеңЁдәәзұ»зҰ»дҪ“иӮқз»ҶиғһдёӯпјҢдјҗе°је…Ӣе…°жңӘиҜұеҜјз»ҶиғһиүІзҙ P450й…¶1A2еҸҠ3A4зҡ„жҙ»жҖ§гҖӮеӣ жӯӨпјҢеҜ№дәҺдё»иҰҒз”ұз»ҶиғһиүІзҙ P450й…¶жүҖд»Ји°ўзҡ„еҢ–еҗҲзү©пјҢдјҗе°је…Ӣе…°ж”№еҸҳе…¶иҚҜд»ЈеҠЁеҠӣеӯҰеҸӮж•°зҡ„еҸҜиғҪжҖ§дёҚеӨ§гҖӮ
4гҖҒжҺ’жі„пјҡдјҗе°је…Ӣе…°зҡ„жё…йҷӨеҚҠиЎ°жңҹзәҰдёә24е°Ҹж—¶пјҢе…¶иӮҫи„ҸжҺ’жі„дё»иҰҒйҖҡиҝҮиӮҫе°Ҹзҗғж»ӨиҝҮеҸҠиӮҫе°Ҹз®ЎеҖҹеҠ©дәҺжңүжңәйҳізҰ»еӯҗиҪ¬иҝҗиӣӢзҷҪOCT2зҡ„дё»еҠЁеҲҶжіҢгҖӮ
5гҖҒзәҝжҖ§/йқһзәҝжҖ§пјҡеҚ•ж¬Ўз»ҷиҚҜ(0.1-3mg)жҲ–йҮҚеӨҚз»ҷиҚҜ(1-3mg/ж—Ҙ)ж—¶пјҢдјҗе°је…Ӣе…°е…·жңүзәҝжҖ§еҠЁеҠӣеӯҰзү№еҫҒгҖӮ
6гҖҒзү№ж®ҠдәәзҫӨзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰпјҡзү№е®ҡиҚҜд»ЈеҠЁеҠӣеӯҰз ”з©¶еҸҠзҫӨдҪ“иҚҜд»ЈеҠЁеҠӣеӯҰеҲҶжһҗжүҖжҳҫзӨәпјҢдјҗе°је…Ӣе…°зҡ„иҚҜд»ЈеҠЁеҠӣеӯҰеҸӮж•°дёҚеӣ е№ҙйҫ„гҖҒз§Қж—ҸгҖҒжҖ§еҲ«гҖҒеҗёзғҹзҠ¶еҶөжҲ–еҗҲ并用иҚҜзҡ„дёҚеҗҢиҖҢеҸ‘з”ҹжңүжҳҫи‘—дёҙеәҠж„Ҹд№үзҡ„еҸҳеҢ–гҖӮ
7гҖҒиӮқеҠҹиғҪжҚҹдјӨжӮЈиҖ…пјҡеӣ дјҗе°је…Ӣе…°еҹәжң¬дёҚз»ҸиӮқи„Ҹд»Ји°ўпјҢиӮқеҠҹиғҪжҚҹдјӨжӮЈиҖ…еә”з”ЁиҜҘиҚҜж—¶е…¶иҚҜд»ЈеҠЁеҠӣеӯҰеҸӮж•°дёҚеҸ—еҪұе“Қ(и§ҒгҖҗз”Ёжі•з”ЁйҮҸгҖ‘)гҖӮ
8гҖҒиӮҫеҠҹиғҪжҚҹдјӨжӮЈиҖ…пјҡеҜ№дәҺиҪ»еәҰиӮҫеҠҹиғҪжҚҹдјӨзҡ„еҸ—иҜ•иҖ…(дј°жөӢиӮҢй…җжё…йҷӨзҺҮ>50ml/minдё”вүӨ80ml/min)пјҢдјҗе°је…Ӣе…°иҚҜд»ЈеҠЁеҠӣеӯҰеҸӮж•°ж— еҸҳеҢ–гҖӮдёҺиӮҫеҠҹиғҪжӯЈеёёеҸ—иҜ•иҖ…(дј°жөӢиӮҢй…җжё…йҷӨзҺҮ>80ml/min)жҜ”иҫғпјҢеҜ№дәҺдёӯеәҰиӮҫеҠҹиғҪжҚҹдјӨ(дј°жөӢиӮҢй…җжё…йҷӨзҺҮвүҘ30ml/minдё”вүӨ50ml/min)зҡ„жӮЈиҖ…пјҢдјҗе°је…Ӣе…°е…Ёиә«жҡҙйңІйҮҸеўһеҠ 1.5еҖҚгҖӮеҜ№дәҺйҮҚеәҰиӮҫеҠҹиғҪжҚҹдјӨ(йў„жңҹиӮҢй…җжё…йҷӨзҺҮ<30ml/min)зҡ„еҸ—иҜ•иҖ…пјҢдјҗе°је…Ӣе…°зҡ„е…Ёиә«жҡҙйңІйҮҸеўһеҠ 2.1еҖҚгҖӮеҜ№дәҺжӮЈжңүз»Ҳжң«жңҹиӮҫз—…(ESRD)зҡ„еҸ—иҜ•иҖ…пјҢдјҗе°је…Ӣе…°еҸҜз»ҸиЎҖж¶ІйҖҸжһҗжңүж•Ҳжё…йҷӨ(и§ҒгҖҗз”Ёжі•з”ЁйҮҸгҖ‘)гҖӮ
9гҖҒиҖҒе№ҙжӮЈиҖ…пјҡиӮҫеҠҹиғҪжӯЈеёёзҡ„иҖҒе№ҙжӮЈиҖ…(65пҪһ75еІҒ)пјҢдјҗе°је…Ӣе…°зҡ„иҚҜд»ЈеҠЁеҠӣеӯҰеҸӮж•°дёҺе№ҙиҪ»жҲҗе№ҙеҸ—иҜ•иҖ…зұ»дјј(и§ҒгҖҗз”Ёжі•з”ЁйҮҸгҖ‘)гҖӮиӮҫеҠҹиғҪеҮҸйҖҖзҡ„иҖҒе№ҙжӮЈиҖ…иҜ·еҸӮиҖғгҖҗз”Ёжі•з”ЁйҮҸгҖ‘гҖӮ
10гҖҒе„ҝз«ҘжӮЈиҖ…пјҡ
йқ’е°‘е№ҙпјҡ
е·ІеңЁ12-17еІҒпјҲеҗ«пјүиҝӣиЎҢдәҶеҚ•еүӮйҮҸе’ҢеӨҡеүӮйҮҸзҡ„иҚҜд»ЈеҠЁеҠӣеӯҰз ”з©¶пјҢеңЁж—ҘеүӮйҮҸ0.5mgеҲ°2mgзҡ„з ”з©¶иҢғеӣҙеҶ…пјҢиҚҜд»ЈеҠЁеҠӣеӯҰеҸӮж•°еҹәжң¬дёҺеүӮйҮҸжҲҗжҜ”дҫӢгҖӮдҪ“йҮҚ>55kgзҡ„йқ’е°‘е№ҙжӮЈиҖ…дёӯпјҢйҮҮз”ЁиҚҜж—¶жӣІзәҝдёӢйқўз§Ҝ(AUC0-24)иҜ„д»·зЁіе®ҡзҡ„дјҗе°је…Ӣе…°е…Ёиә«жҡҙйңІйҮҸпјҢе…¶з»“жһңдёҺзӣёеҗҢеүӮйҮҸзҡ„жҲҗдәәдәәзҫӨзӣёеҪ“гҖӮиӢҘеүӮйҮҸдёәжҜҸж—ҘдёӨж¬Ў0.5mgпјҢдҪ“йҮҚвүӨ55kgзҡ„йқ’е°‘е№ҙжӮЈиҖ…зҡ„зЁіе®ҡдјҗе°је…Ӣе…°ж—ҘжҡҙйңІйҮҸе№іеқҮй«ҳдәҺжҲҗдәә(й«ҳзәҰ40%)гҖӮ 18еІҒд»ҘдёӢе„ҝз«ҘдәәзҫӨзҡ„з–—ж•ҲеҸҠе®үе…ЁжҖ§е°ҡжңӘзЎ®иҜҒпјҢеӣ жӯӨпјҢж— жҺЁиҚҗеүӮйҮҸ(и§ҒгҖҗз”Ёжі•з”ЁйҮҸгҖ‘)гҖӮ
гҖҗиҙ®и—ҸгҖ‘еҜҶе°ҒпјҢ25в„ғд»ҘдёӢдҝқеӯҳгҖӮ
гҖҗеҢ…иЈ…гҖ‘жҲ’зғҹз»ҙжҢҒиЈ…пјҲй“қеЎ‘еҢ…иЈ…пјүпјҢ1mg*28зүҮ/зӣ’гҖӮ
гҖҗжңү ж•Ҳ жңҹгҖ‘36дёӘжңҲ
гҖҗе…¬еҸёеҗҚз§°гҖ‘Pfizer Limited
гҖҗз”ҹдә§дјҒдёҡгҖ‘R-Pharm Germany GmbH















 е®ҳж–№еҫ®дҝЎ
е®ҳж–№еҫ®дҝЎ
 жүӢжңәе•ҶеҹҺ
жүӢжңәе•ҶеҹҺ